-
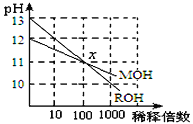
MOH强碱溶液和等体积、等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是
A. c(M+)>c(OH-)>c(A-)>c(H+) B. c(M+)>c(A-)>c(H+)>c(OH-)
C. c(M+)>c(A-)>c(OH-)>c(H+) D. c(M+)>c(H+)>c(A-)>c(OH-)
难度: 困难查看答案及解析
-
为了建设环境友好型社会,节能减排将成为我国政府目前工作的重点,因此节约能源与建设新能源是摆在当前的一个课题。针对这一现象,某化学学习研究性小组提出如下方案,你认为不够科学合理的是( )
A. 采用电解水法制取氢气作为新能源 B. 完善煤液化制取汽油的技术
C. 研制推广以甲醇为燃料的汽车 D. 进一步提高石油加工工艺
难度: 简单查看答案及解析
-
下列说法中正确的是
A.有能量变化的过程一定是化学变化过程 B.需要加热才能发生的反应是吸热反应
C.化学反应中一定伴有热量的变化 D.物质发生燃烧的反应一定是放热反应
难度: 简单查看答案及解析
-
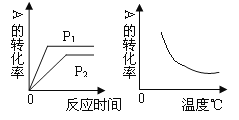
对于反应:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是( )
A. v(NH3)= 0.2mol·L-1·s-1 B. v(O2 )= 0.24 mol·L-1·s-1
C. v(H2O )= 0.25 mol·L-1·s-1 D. v(NO) = 0.15 mol·L-1·s-1
难度: 中等查看答案及解析
-
一定条件下密闭容器中发生反应:NO(g) + CO(g)
1/2N2(g) + CO2(g) △H = —373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A. 升高温度 B. 充入NO C. 增大压强 D. 加催化剂
难度: 中等查看答案及解析
-
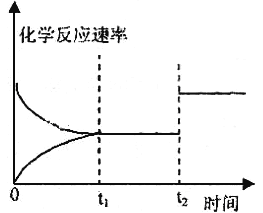
在一个绝热的体积一定的密闭容器中发生可逆反应:N2(g) + 3H2(g)
2NH3(g) , △H<0,下列各项中不能说明该反应已经达到平衡状态的是
A. 体系的压强不再改变
B. 体系的温度不再改变
C. 断裂1mol N≡N键的同时,也断裂6molN—H键
D. 反应消耗的N2、H2与产生的NH3的速率υ(N2) : υ(H2) : υ(NH3) ==1∶3 ∶2
难度: 中等查看答案及解析
-
一定条件下,下列反应呈平衡状态时的平衡常数:2N2(g) + 6H2(g)
4NH3(g) K1 2NH3(g)
N2(g) + 3H2(g) K2 。则K1与K2的关系为( )
A. K1 = K2 B. K1 2= K2 C. K2 2= 1/K1 D. 无法确定
难度: 中等查看答案及解析
-
能说明醋酸是弱酸的是( )
A. 醋酸能与NaOH反应 B. 醋酸能使石蕊变红
C. 醋酸钠溶液pH>7 D. 醋酸与碳酸钙反应放出二氧化碳
难度: 简单查看答案及解析
-
参照反应Br + H2
HBr +H的能量对反应历程的示意图,下列叙述中正确的
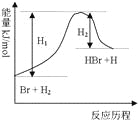
A. 正反应为放热反应
B. 加入催化剂,该化学反应的反应热改变
C. 正反应为吸热反应
D. 加入催化剂可增大正反应速率,降低逆反应速率
难度: 中等查看答案及解析
-
下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O
HCOO- + H3O+
B.CO2+H2O
HCO3- + H+ 1111
C.CO32- + H2O
HCO3- + OH-1
D.HS- + H2O
S2- + H3O+
难度: 中等查看答案及解析
-
下列说法正确的是
A. 水解反应是吸热反应 B. 升高温度可以抑制盐类的水解
C. 正盐水溶液pH均为7 D. 硫酸钠水溶液pH小于7
难度: 简单查看答案及解析
-
室温下,某无色透明溶液中由水电离出来的H+ 浓度为1×10—12 mol/L,则此溶液中一定能大量共存的离子组为( )
A. HCO3—、Al3+、Na+、SO42— B. NO3—、SO42—、Na+、Cl—
C. MnO4—、Cl—、SO42—、K+ D. I—、NO3—、K+、NH4+
难度: 中等查看答案及解析