-
已知“凡气体分子总数增加的反应都是熵增大的反应”。下列反应中,在任何温度下都不自发进行的是
A. 2O3(g)=3O2(g) △H<0 B. 2CO(g)=2C(s)+O2(g) △H>0
C. N2(g)+3H2(g)=2NH3(g ) △H<0 D. CaCO3(s)=CaO(s)+CO2(g) △H>0
难度: 中等查看答案及解析
-
下列事实能说明亚硝酸是弱电解质的是
①25 ℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电试验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应 ④0.1 mol·L-1 HNO2溶液的pH=2.1
A. ①②③ B. ②③④ C. ①④ D. ①②④
难度: 中等查看答案及解析
-
下列各项中的两个量,其比值一定为2∶1的是
A. 液面在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛液体的体积
B. 相同温度下,0.2 mol·L-1醋酸溶液和0.1 mol·L-1醋酸溶液中的c(H+)
C. 在(NH4)2SO4溶液中,c(NH4+)与c(SO42-)
D. 相同温度下,等浓度的Ba(OH)2和NaOH溶液中的c(OH-)
难度: 中等查看答案及解析
-
下列方程式书写正确的是( )
A. NaHSO4在水溶液中的电离方程式:NaHSO4===Na++
B. H2SO3的电离方程式:H2SO3
2H++
C. CO
的水解方程式:
+H2O
+OH-
D. CaCO3的电离方程式:CaCO3
Ca2++
难度: 简单查看答案及解析
-
室温下,某无色透明溶液中水电离出的H+和OH-的物质的量浓度乘积为1×10-26,一定能大量共存的离子组是( )
A. Cl—、HCO3—、Na+、K+ B. Fe3+、NO3—、K+、H+
C. NO3—、Ba2+、K+、Cl— D. Al3+、SO42—、NH4+、Cl—
难度: 中等查看答案及解析
-
一定量的混合气体在密闭容器中发生反应 mA(g)+nB(g)
pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/3,达到平衡时,C的浓度为原来的2.5倍,则下列说法正确的是
A. C的体积分数增加 B. A的转化率降低
C. 平衡向正反应方向移动 D. m+n>p
难度: 困难查看答案及解析
-
将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一.已知:
TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140.5kJ・mol﹣1
C(s,石墨)+O2(g)═CO2(g)△H=﹣110.5kJ・mol﹣1
则反应TiO2(s)+2Cl2(g)+C(s,石墨)═TiCl4(l)+CO2(g)的△H是
A. +30.0kJ・mol﹣1 B. ﹣80.5kJ・mol﹣1
C. ﹣30.0kJ・mol﹣1 D. +80.5kJ・mol﹣1
难度: 困难查看答案及解析
-
下列物质的溶液在蒸发皿中加热蒸干并灼烧,可以得到该物质本身的是( )
①CuSO4;②KHCO3;③FeSO4;④NH4Cl;⑤MgSO4;⑥AlCl3 ;
A. ①③ B. ①⑤ C. ①③⑤ D. ①②⑥
难度: 中等查看答案及解析
-
一定温度下体积固定的密闭中的反应A(g)+3B(g)
2C(g),下列叙述不能表明该反应达到平衡状态的是( )
A. 容器中压强不再变化 B. 单位时间内生成amolA,同时消耗2amolC
C. C的消耗速率是A的消耗速率的2倍 D. B的体积分数不再变化
难度: 中等查看答案及解析
-
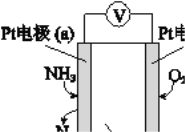
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示。则下列说法正确的是 ( )。
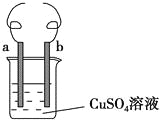
A. 构成原电池时b极反应为Cu-2e-=Cu2+
B. 构成电解池时a极质量一定减少
C. 构成电解池时b极质量可能减少也可能增加
D. 构成的原电池或电解池工作后可能产生大量气体
难度: 中等查看答案及解析
-
下列说法错误的是( )
A. 弱酸pH=a,加水稀释到10n倍,则pH<a+n (a+n<7)
B. 中和相同体积相同pH的盐酸和醋酸溶液所需NaOH的物质的量不相同,醋酸消耗NaOH的物质的量多
C. pH=3的一元酸和pH=11的一元碱等体积混合后,混合液中一定存在c(H+)=c(OH-)
D. 常温,pH=2的盐酸、pH=2的醋酸中由水电离出的c(H+)=c(OH-)=10-12 mol·L-1
难度: 中等查看答案及解析
-
25℃时,几种弱酸的电离常数如下:
弱酸化学式
CH3COOH
HCN
H2S
电离常数(25℃)
1.8×10-5
4.9×10-10
K1= 1.3×10-7 K2= 7.1×10-15
25℃时,下列说法正确的是
A. NaHS和Na2S混合溶液中,一定存在c(Na+)+ c(H+)== c(OH-)+ c(HS-)+2c(S2-)
B. 等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
C. a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)> c(CN-),则a一定大于b
D. 足量HCN溶液与Na2S溶液混合后,有H2S生成
难度: 中等查看答案及解析
-
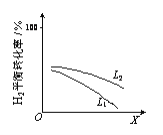
反应A2+B2
2AB在不同条件下,产物AB百分含量随时间变化关系如图所示,a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
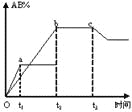
A. A2、B2、AB均为气体,正反应放热
B. AB为气体,A2、B2中最少有一种为非气体,正反应放热
C. AB为气体,A2、B2中最少有一种为非气体,正反应吸热
D. AB为固体,A2、B2中最少有一种为非气体,正反应吸热
难度: 困难查看答案及解析
-
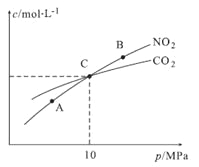
一定条件下合成乙烯:6H2(g)+2CO2(g)
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
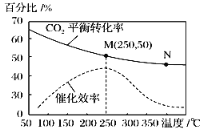
A. 生成乙烯的速率:v(N)一定大于v(M) B. 该反应的逆反应为吸热反应
C. 平衡常数:KM>KN D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
难度: 中等查看答案及解析
-
清华大学王晓琳教授首创三室膜电解法制备LiOH,其工作原理如图所示,下列有关说法正确的是
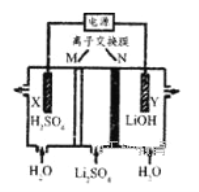
A. X电极连接电源负极
B. N为阳离子交换膜
C. Y电极反应式为 O2+2H2O+4e-=4OH-
D. 制备2.4g LiOH产生的H2在标准状况下为2.24 L
难度: 困难查看答案及解析
-
下列装置或操作能达到目的是
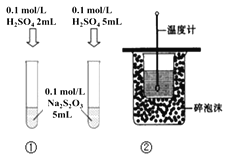
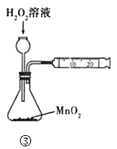
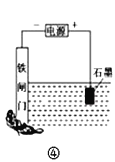
A. 装置①探究H2SO4浓度对反应速率的影响 B. 装置②可用于测定中和热
C. 装置③测定O2的生成速率 D. 装置④保护铁闸门不被腐蚀
难度: 中等查看答案及解析
-
下列关于电解质溶液中离子关系的说法正确的是( )
A. 0.1 mol·L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(
)+c(
)+c(H2CO3)
B. 把0.2 mol/L NH4Cl溶液与0.1 mol/L NaOH溶液等体积混合后离子浓度关系:c(Cl-)>c(
)>c(H+)>c(OH-)
C. 常温,向醋酸钠溶液中滴加少量醋酸使其pH=7,则混合液中:c(Na+)=c(CH3COO-)
D. 在Na2CO3溶液中,c(H+)+c(
)+c(H2CO3)= c(OH-)
难度: 中等查看答案及解析
-
常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。下列说法正确的是
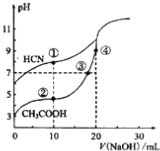
A. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
C. 点④所示溶液液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
难度: 困难查看答案及解析