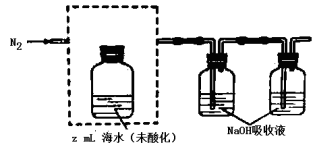
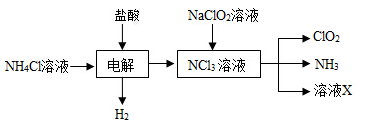
-
化学与社会、生产密切相关,下列说法正确的是:
A、高纯度的单晶硅用于制造光导纤维
B、从海水中提取物质都必须通过化学反应才能实现
C、乙酸乙酯在碱性条件下水解称为皂化反应
D、可溶性铜盐有毒,在生命体中铜是一种不可缺少的微量元素
难度: 简单查看答案及解析
-
下列说法正确的是
A.地沟油和矿物油都属于酯类物质
B.人们用明矾对水进行消毒、杀菌
C.反应
 原子利用率最高
原子利用率最高D.甲烷、苯和油脂均不能使酸性KMnO4溶液褪色
难度: 简单查看答案及解析
-
下列说法错误的是
A.石油的炼制过程不都是化学变化
B.煤中含有苯和甲苯,可用蒸馏的方法将它们分离
C.煤是工业上获得芳香烃的一种重要原料
D.煤通过液化和气化处理能减少环境污染
难度: 简单查看答案及解析
-
下列说法中有明显错误的是( )
A.对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B.升高温度,可使活化分子的百分数增大,因而反应速率增大
C.活化分子之间发生的碰撞一定为有效碰撞
D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率
难度: 中等查看答案及解析
-
在浅绿色的Fe(NO3)2溶液中存在如下平衡:Fe2++2H2O
Fe(OH)2+2H+,若向该溶液中滴 加足量的盐酸,则溶液的颜色( )
A.绿色更浅 B.绿色更深 C.变黄 D.无变化
难度: 中等查看答案及解析
-
下列事实不能用平衡移动原理解释的是
A.由H2、I 2(g)、HI组成的平衡体系,加压后颜色加深
B.用加热蒸干AlCl3溶液的方法不能制得无水AlCl3
C.蒸馏水和0.1 mol•L-1 NaOH溶液中的c(H+),前者大于后者
D.向含有少量Fe3+的MgCl2酸性溶液中加MgCO3,可将Fe3+转化成Fe(OH)3除去
难度: 中等查看答案及解析
-
将0.1mol下列物质置于1 L水中充分搅拌后,溶液中阴离子数最多的是
A、KCl B、Mg(OH)2 C、Na2CO3 D、MgSO4
难度: 中等查看答案及解析
-
下列实验误差分析正确的是
A、用湿润的pH试纸测稀碱液的pH,测定值偏大
B、用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D、测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏大
难度: 简单查看答案及解析
-
工业上向锅炉里注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3而后用盐酸去除。下列叙述不正确的是
A.温度升高,Na2CO3溶液的Kw和c(OH一)均会增大
B.沉淀转化的离子方程式为CO32-+CaSO4=CaCO3+SO42-
C.盐酸溶液中,CaCO3的溶解性大于CaSO4
D.Na2CO3溶液遇CO2后,阴离子浓度均减小
难度: 困难查看答案及解析
-
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )

A.加入催化剂,减小了反应的热效应
B.加入催化剂,可提高H2O2的平衡转化率
C.H2O2分解的热化学方程式:H2O2 → H2O + O2 △H<0
D.反应物的总能量高于生成物的总能量
难度: 中等查看答案及解析
-
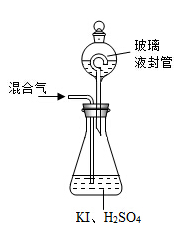
某探究小组用如图所示装置进行如下实验,其实验现象描述正确的是( )
选项
a中试剂
b中试剂
实验现象
A
1mL12mol•L﹣1浓盐酸,0.5gMnO2
0.1gCaCO3、1mL
2mol•L﹣1盐酸
红墨水褪色,U形管中液面左右基本持平
B
0.1gNa,3mol水
0.1gNa 3mol乙醇
反应开始阶段,反应结束静置一段时间后U形管中液面都是左低右高
C
3mL浓硫酸、铁钉
3mLNaCl溶液、铁钉
铁钉均生锈,U形管中液面左高右低
D
3mL水
3mL饱和FeSO4溶液
一段时间后,U形管中液面左低右高,b管溶液中出现红褐色浑浊物
难度: 困难查看答案及解析
-
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
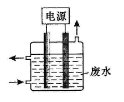
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
难度: 极难查看答案及解析
-
下列说法正确的是( )
A.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
C.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023
D.一定条件下反应N2+3H2
2NH3达到平衡时,3v正(H2)=2v逆(NH3)
难度: 中等查看答案及解析
-
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g)
COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
难度: 困难查看答案及解析
-
下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5)和一氯乙酸(乙,Ka=1.4×10-3)在水中的电离度与浓度关系的是( )

难度: 困难查看答案及解析
-
对于合成氨反应,达到平衡后,以下分析正确的是( )
A.升高温度,对正反应的反应速率影响更大
B.增大压强,对正反应的反应速率影响更大
C.减小反应物浓度,对逆反应的反应速率影响更大
D.加入催化剂,对逆反应的反应速率影响更大
难度: 中等查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是( )
A.热稳定性:Na2CO3>NaHCO3 B.非金属性:Cl>Br\
C.碱性:NaOH>Mg(OH)2 D.酸性:H2SO4>H3PO4
难度: 中等查看答案及解析
-
室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )
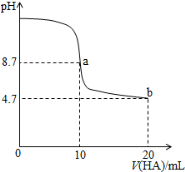
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A—)+ c(HA)
D.b点所示溶液中c(A—)> c(HA)
难度: 极难查看答案及解析
-
下列说法不正确的是( )
A.Na与H2O的反应是熵增的放热反应,该反应能自发进行
B.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同
C.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)
Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
难度: 中等查看答案及解析
-
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
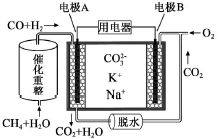
A.反应CH4+H2O
3H2+CO,每消耗1molCH4转移12mol 电子
B.电极A上H2参与的电极反应为:
H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
难度: 困难查看答案及解析
-
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A.m=2 B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1 D.第二次平衡时,Z的浓度为0.4 mol·L-1
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知YW的原子序数之和是Z的3倍,下列说法正确的是( )
Y
Z
X
W
A.原子半径:X<Y<Z
B.气态氢化物的稳定性:X>Z
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
难度: 中等查看答案及解析
-
在体积均为1.0L的两个恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
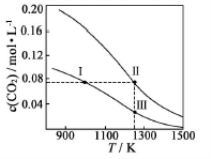
A.反应CO2(g)+c(s)
2CO(g) △S>0、△H<0
B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ) >2c(CO,状态Ⅲ)
D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ)
难度: 极难查看答案及解析
-
25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2﹣最低浓度的对数值lgc(S2﹣)与lgc(M2+)的关系如图所示,下列说法不正确的是( )
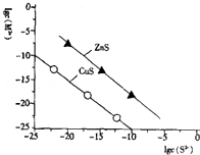
A.25℃时K(CuS)约为1×10﹣35
B.向100mLZn2+、Cu2+浓度均为10﹣5mol•L﹣1的混合溶液 中逐滴加入10﹣4mol•L﹣1的Na2S溶液,Cu2+先沉淀
C.Na2S溶液中:c(S2﹣)+c(HS﹣)+c(H2S)═2c(Na+)
D.向Cu2+浓度为10﹣5mol•L﹣1的工业废水中加入ZnS粉末,会有CuS沉淀析出
难度: 极难查看答案及解析
-
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
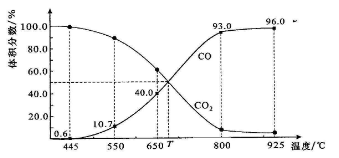
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是( )
A.550℃时,若充入惰性气体,v正,v逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
难度: 困难查看答案及解析