-
能够用键能的大小作为主要依据来解释的是( )
A. 常温常压下氯气呈气态而溴单质呈液态
B. 硝酸是挥发性酸,而硫酸、磷酸是不挥发性酸
C. 稀有气体一般难于发生化学反应
D. 空气中氮气的化学性质比氧气稳定
难度: 中等查看答案及解析
-
某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
A. 配合物中中心原子的电荷数和配位数均为6
B. 该配合物可能是平面正方形结构
C. Cl-和NH3分子均为Pt4+配体
D. 配合物中Cl-与Pt4+配位,而NH3分子不配位
难度: 中等查看答案及解析
-
有关核外电子运动规律的描述错误的是
A. 核外电子质量很小,在原子核外作高速运动
B. 核外电子的运动规律与普通物体不同,不能用牛顿运动定律来解释
C. 在电子云示意图中,通常用小黑点来表示电子绕核作高速圆周运动
D. 在电子云示意图中,小黑点密表示电子在核外空间单位体积内电子出现的机会多
难度: 简单查看答案及解析
-
能说明BF3分子的4个原子在同一平面的理由是( )
A. 任意两个B—F键之间的夹角为120°
B. B—F键为极性共价键
C. 三个B—F键的键能相同
D. 三个B—F键的键长相同
难度: 中等查看答案及解析
-
下面的排序不正确的是( )
A. 晶体熔点由低到高:F2<Cl2<Br2<I2
B. 熔点由高到低: Na>Mg>Al
C. 硬度由大到小: 金刚石>碳化硅>晶体硅
D. 晶格能由大到小: MgO>CaO>NaF> NaCl
难度: 中等查看答案及解析
-
下列原子中未成对电子数最多的是( )
A. C B. O C. N D. Cl
难度: 中等查看答案及解析
-
下列元素相关粒子的电子排布式中,前者一定是金属元素,后者一定是非金属元素的是( )
A. [Ne]3s1 [Ne]3s2 B. [Ar]4s1 [Ne]3s23p4
C. [Ne]3s2 [Ar]4s2 D. [He]2s22p4 [Ne]3s23p5
难度: 中等查看答案及解析
-
为了确定SbCl3、SbCl5是否为离子化合物,以下分析正确的是
A. 常温下,SbCl3、SbCl5均为液体,说明SbCl3和SbCl5都是离子化合物
B. SbCl3、SbCl5的熔点依次为73.5℃、2.8℃。说明SbCl3、SbCl5都不是离子化合物
C. SbCl3、SbCl5溶液中,滴入酸化的AgNO3溶液,产生白色沉淀。说明:SbCl3、SbCl5都是离子化合物
D. SbCl3、SbCl5的水溶液都可以导电。说明:SbCl3、SbCl5都是离子化合物
难度: 中等查看答案及解析
-
某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素,关于该元素的判断错误的是 ( )。
A. 电子排布式为1s22s22p63s23p63d34s2
B. 该元素为V
C. 该元素为ⅡA族元素
D. 该元素位于d区
难度: 简单查看答案及解析
-
下列说法中正确的是()
A. 基态原子是处于最低能量状态的原子
B. 基态C原子的电子排布式是1s22s12p3
C. 焰色反应是金属原子的电子从基态跃迁到激发态时产生的光谱
D. 同一原子处于激发态时的能量一定低于基态时的能量
难度: 简单查看答案及解析
-
下列过程与配合物的形成无关的是( )
A. 除去Fe粉中的SiO2可用于强碱溶液
B. 向一定量的AgNO3溶液中加入氨水至沉淀消失
C. 向Fe3+溶液中加入KSCN溶液
D. 向一定量的CuSO4溶液中加入氨水至沉淀消失
难度: 中等查看答案及解析
-
钛号称“崛起的第三金属”,因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域。已知钛有48Ti、49Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是( )
A. 上述钛原子中,中子数不可能为22
B. 钛元素在周期表中处于第四周期ⅡB族
C. 钛原子的外围电子排布为3d24s2
D. 钛元素位于元素周期表的d区,是过渡元素
难度: 简单查看答案及解析
-
支持固态氨是分子晶体的事实为( )
A. 氮原子不能形成阳离子 B. 铵离子不能单独存在
C. 常温下氨是气态物质 D. 氨极易溶于水
难度: 中等查看答案及解析
-
下列原子半径最小的是( )
A. 1s22s22p3 B. 1s22s22p33s23p3
C. 1s22s22p5 D. 1s22s22p33s23p2
难度: 简单查看答案及解析
-
乙烯分子中含有4个C—H键和1个C=C键,6个原子在同一平面上。下列关于乙烯分子的成键情况分析正确的是 ( )
①每个C原子的2s轨道与2p轨道杂化,形成两个sp杂化轨道 ②每个C原子的2s轨道与2个2p轨道杂化,形成3个sp2杂化轨道 ③每个C原子的2s轨道与3个2p轨道杂化,形成4个sp3杂化轨道 ④每个C原子的3个价电子占据3个杂化轨道,1个价电子占据1个2p轨道
A. ①③ B. ②④ C. ①④ D. ②③
难度: 中等查看答案及解析
-
某元素的原子核外有三个电子层,其3p能级上的电子数是3s能级上的一半,则此元素是( )
A. S B. Al C. Si D. Cl
难度: 简单查看答案及解析
-
下列有关范德华力的叙述正确的是( )
A. 范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键
B. 范德华力与化学键的区别是作用力的强弱不同
C. 任何分子间在任意情况下都会产生范德华力
D. 范德华力非常微弱,故破坏范德华力不需要消耗能量
难度: 简单查看答案及解析
-
根据价层电子对互斥模型,判断下列分子或者离子的空间构型不是三角锥形的( )
A. PCl3 B. H3O+ C. HCHO D. PH3
难度: 中等查看答案及解析
-
下列关于杂化轨道的说法错误的是
A. 所有原子轨道都参与杂化
B. 同一原子中能量相近的原子轨道参与杂化
C. 杂化轨道能量集中,有利于牢固成键
D. 杂化轨道中不一定有一个电子
难度: 中等查看答案及解析
-
在40 GPa高压下,用激光器加热到1 800 K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是( )
A. 原子晶体干冰易汽化,可用作制冷剂
B. 原子晶体干冰有很高的熔点和沸点
C. 原子晶体干冰的硬度小,不能用作耐磨材料
D. 1 mol原子晶体干冰中含2 mol C—O键
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 分子晶体中一定存在分子间作用力,不一定存在共价键
B. 分子中含两个氢原子的酸一定是二元酸
C. 含有共价键的晶体一定是分子晶体
D. 元素的非金属性越强,其单质的活泼性一定越强
难度: 中等查看答案及解析
-
利用晶体结构,可以用来解释( )
A. 晶体有规则的几何外形,非晶体没有规则的几何外形
B. 晶体有一定的熔点,非晶体没有一定的熔点
C. 晶体的导电性能比非晶体好
D. 晶体的各向异性
难度: 困难查看答案及解析
-
下列各微粒中,各能层电子数均达到2n2的是( )
A. Ne,Ar B. F-,Mg2+
C. Al,O2- D. Cl-,Ar
难度: 中等查看答案及解析
-
下列不属于元素电负性的应用的是( )
A. 判断一种元素是金属还是非金属
B. 判断化合物中元素的正负化合价
C. 判断化学键类型
D. 判断单质的熔沸点
难度: 中等查看答案及解析
-
COCl2分子的结构式为
,COCl2分子内含有
A. 4个σ键 B. 2个σ键,2个π键
C. 2个σ键、1个π键 D. 3个σ键、1个π键
难度: 中等查看答案及解析
-
下列分子的中心原子的杂化轨道类型相同的是 ( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H4与C2H2
难度: 中等查看答案及解析
-
氮化硼(BN)是一种新型结构材料,具有超硬、耐磨、耐高温等优良特性,下列各组物质熔化时,所克服的微粒间作用与氮化硼熔化时克服的微粒间作用都相同的是( )
A. 硝酸钠和金刚石 B. 晶体硅和水晶
C. 冰和干冰 D. 苯和萘
难度: 简单查看答案及解析
-
下列关于合金的叙述不正确的是
A.合金的熔点一般比它的各成分金属的熔点低
B.合金的硬度一般比它的各成分金属的硬度大
C.合金的性质一般是各成分金属性质的总和
D.合金在工业上的用途比纯金属更广
难度: 简单查看答案及解析
-
已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的( )
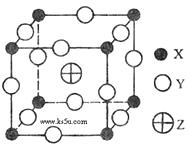
A. ZXY3 B. ZX2Y6 C. ZX4Y8 D. ZX8Y12
难度: 中等查看答案及解析


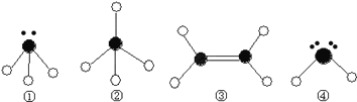
 (2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;