-
能够用键能的大小作为主要依据来解释的是( )
A. 常温常压下氯气呈气态而溴单质呈液态
B. 硝酸是挥发性酸,而硫酸、磷酸是不挥发性酸
C. 稀有气体一般难于发生化学反应
D. 空气中氮气的化学性质比氧气稳定
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B. CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C. H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
D. CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线的中央
难度: 中等查看答案及解析
-
下列事实与氢键有关的是( )
A. 水加热到很高的温度都难以分解
B. 水结冰体积膨胀
C. CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高
D. HF、HCl、HBr、HI的热稳定性依次减弱
难度: 中等查看答案及解析
-
电子在一个原子的下列能级中排布时,最后一个排布的是( )
A. ns B. np C. (n-1)d D. (n-2)f
难度: 简单查看答案及解析
-
具有下列电子排布式的原子中,半径最大的是( )
A. 1s22s22p63s23p5 B. 1s22s22p3
C. 1s22s22p2 D. 1s22s22p63s23p4
难度: 简单查看答案及解析
-
下列说法中不正确的是( )
A. 共价化合物中不可能含有离子键
B. 有共价键的化合物,不一定是共价化合物
C. 离子化合物中可能存在共价键
D. 以极性键结合的分子,肯定是极性分子
难度: 中等查看答案及解析
-
下列有关离子晶体的数据大小比较不正确的是( )
A. 熔点:NaF>MgF2>AlF3
B. 晶格能:NaF>NaCl>NaBr
C. 阴离子的配位数:CsCl>NaCl>CaF2
D. 硬度:MgO>CaO>BaO
难度: 中等查看答案及解析
-
科学研究证明核外电子的能量不仅与电子所处的能层、能级有关,还与核外电子数及核电荷数有关。氩原子与硫离子的核外电子排布相同,核外电子排布式都是1s22s22p63s23p6。下列说法正确的是( )
A. 两粒子1s能级上电子的能量相同
B. 两粒子3p能级上的电子离核的距离相同
C. 两粒子的电子发生跃迁时,释放出的能量不同
D. 两粒子都达到8电子稳定结构,化学性质相同
难度: 中等查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法,不正确的是
A. NH5中既有离子键又有共价键 B. NH5的熔沸点高于NH3
C. 1mol NH5中含有5molN—H键 D. NH5固体投入少量水中,可产生两种气体
难度: 中等查看答案及解析
-
下列有关共价键的叙述中,不正确的是( )
A. 某原子跟其他原子形成共价键时,其共价键数一定等于该元素原子的价电子数。
B. 水分子内氧原子结合的电子数已经达到饱和,故不能再结合其他氢原子。
C. 非金属元素原子之间形成的化合物也可能是离子化合物
D. 所有简单离子的核电荷数与其核外电子数一定不相等。
难度: 简单查看答案及解析
-
下列化合物的沸点比较,前者低于后者的是 ( )
A. 乙醇与氯乙烷
B. 邻羟基苯甲酸与对羟基苯甲酸
C. 对羟基苯甲醛与邻羟基苯甲醛
D. H2O与H2Te
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 3d3表示3d能级上有3个轨道
B. ns能级的原子轨道图都可以用如图表示
C. 1s电子云呈球形,表示电子绕原子核做圆周运动
D. 电子云图的黑点密度越大,说明核外空间电子数越多
难度: 简单查看答案及解析
-
下列有关电负性的说法中不正确的是( )
A. 元素的电负性越大,原子在化合物中吸引电子的能力越强
B. 主族元素的电负性越大,元素原子的第一电离能一定越大
C. 在元素周期表中,元素电负性从左到右呈现递增的趋势
D. 形成化合物时,电负性越小的元素越容易显示正价
难度: 中等查看答案及解析
-
下列说法正确的是( )
①“构造原理”是所有原子随原子序数递增,核外电子排布遵循的规律 ②4s轨道的能量一定比3d轨道的能量低 ③同一电子层中三个p轨道的能量一定相等 ④原子核外电子排布遵循“使整个原子处于能量最低的状态”为总原则
A. ①② B. ②③④ C. ②④ D. ①③
难度: 中等查看答案及解析
-
下列各基态原子的核外电子排布表示正确的是( )
A. 钠原子:1s22s22p7 B. 铜原子:1s22s22p63s23p63d94s2
C. 铁原子:1s22s22p63s23p63d8 D. 氪原子:1s22s22p63s23p63d104s24p6
难度: 简单查看答案及解析
-
金属元素铊的相关信息如下图所示。下列有关卡片信息解读错误的是( )

A. Tl是铊的元素符号 B. 铊元素的中子数81
C. 铊位于第六周期ⅢA族 D. 铊属于金属元素
难度: 简单查看答案及解析
-
支撑“宇宙爆炸”理论的重要事实之一( )
A. 宇宙原子总数的88.6%是氢
B. 地球上的元素绝大多数是金属
C. 普鲁特“氢是所有元素之母”的预言
D. 宇宙中存在极少量稀有气体分子
难度: 简单查看答案及解析
-
某元素X的逐级电离能如图所示,下列说法正确的是( )
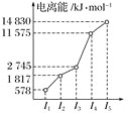
A. X元素可能为+4价 B. X可能为非金属
C. X为第五周期元素 D. X与氯反应时最可能生成的阳离子为X3+
难度: 中等查看答案及解析
-
在下列化学反应中,所断裂的共价键中,仅仅断裂δ键的是 ( )
A. N2+3H2
 2NH3
2NH3B. 2C2H2+5O2
 2H2O+4CO2
2H2O+4CO2C. Cl2+H2
 2HCl
2HClD. C2H4+H2
C2H6
难度: 中等查看答案及解析
-
下列有关金属晶体的说法中不正确的是( )
A. 金属晶体是一种“巨型分子”
B. “电子气”为所有原子所共有
C. 简单立方堆积的空间利用率最低
D. 体心立方堆积的空间利用率最高
难度: 简单查看答案及解析
-
下列性质适合于离子晶体的是( )
①熔点1 070 ℃,易溶于水,水溶液能导电
②熔点10.31 ℃,液态不导电,水溶液能导电
③能溶于CS2,熔点112.8 ℃,沸点444.6 ℃
④熔点97.81 ℃,质软,导电,密度0.97 g/cm3
⑤熔点-218 ℃,难溶于水
⑥熔点3 900℃,硬度很大,不导电
⑦难溶于水,固体时导电,升温时导电能力减弱
⑧难溶于水,熔点高,固体不导电,熔化时导电
A. ①⑧ B. ②③⑥ C. ①④⑦ D. ②⑤
难度: 中等查看答案及解析
-
水分子间可通过氢键彼此结合而形成(H2O)n,在冰中n值为5,即每个水分子被其他4个水分子包围形成变形四面体,如图所示为(H2O)5单元,由无限个这样的四面体通过氢键构成一个庞大的分子晶体,即冰。下列有关叙述正确的是

A. 1 mol冰中含有4 mol氢键
B. 1 mol冰中含有4×5 mol氢键
C. 平均每个水分子只含有2个氢键
D. 平均每个水分子只含有5/4个氢键
难度: 中等查看答案及解析
-
已知铜的晶胞结构如图所示,则在铜的晶胞中所含铜原子数及配位数分别为( )

A. 14、6 B. 14、8 C. 4、8 D. 4、12
难度: 简单查看答案及解析
-
短周期非金属元素X和Y能形成XY2型化合物,下列有关XY2的判断不正确的是( )
A. XY2一定是分子晶体
B. XY2的电子式可能是:
: :X: :
:
C. XY2水溶液不可能呈碱性
D. X可能是ⅣA,ⅤA或ⅥA族元素。
难度: 中等查看答案及解析
-
下列化学式能真实表示物质分子组成的是
A. NaOH B. SO3 C. CsCl D. SiO2
难度: 简单查看答案及解析
-
下列物质固态时熔点的比较正确的是( )
A. F2>Cl2>Br2 B. 金刚石>P4>O2
C. S>HBr>金刚石 D. I2>CH4>冰
难度: 中等查看答案及解析

 。
。