-
下列物质在水溶液中促进了水的电离的是
A. NaHSO4 B. HClO C. NaCl D. CuSO4
难度: 简单查看答案及解析
-
下列热化学方程式中ΔH表示可燃物燃烧热的是
A. CO(g)+1/2O2(g)===CO2(g) ΔH=-283 kJ·mol-1
B. CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
D. H2(g)+Cl2(g)===2HCl(g) ΔH=-184.6 kJ·mol-1
难度: 简单查看答案及解析
-
能说明醋酸是弱电解质的事实是( )
A. 醋酸水溶液能使湿润的蓝色石蕊试纸变红
B. 醋酸和碳酸钠溶液反应放出二氧化碳
C. c(H+)相同的醋酸和盐酸相比较,醋酸溶液的浓度大
D. 浓度和体积均相同的醋酸和盐酸可中和等物质的量的NaOH
难度: 中等查看答案及解析
-
下列反应属于吸热反应的是
A. 酸碱中和反应 B. 火药爆炸
C. 木炭燃烧 D. Ba(OH)2•8H2O晶体与NH4Cl晶体的反应
难度: 简单查看答案及解析
-
反应 A + B→C + Q分两步进行 ①A + B→X - Q;②X→C + Q。下列示意图中,能正确表示总反应过程中能量变化的是

A
B
C
D
难度: 简单查看答案及解析
-
已知反应2HI(g)
H2(g)+I2(g)的ΔH=+11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为
A. 598kJ B. 299kJ C. 149.5kJ D. 306kJ
难度: 简单查看答案及解析
-
在N2+3H2
2NH3的反应中,各物质的起始浓度分别为:c(H2)=4 mol·L-1,c(N2)=3 mol·L-1,c(NH3)=0.5 mol·L-1,经3 min后,c(NH3)=0.8 mol·L-1,该反应的反应速率是
A. v(H2)=0.7 mol·(L·min)–1 B. v(NH3)=0.3 mol·(L·min)-1
C. v(H2)=0.2 mol·(L·min)-1 D. v(H2)=0.15 mol·(L·min)-1
难度: 简单查看答案及解析
-
如图表示在某温度下经时间t反应后,物质x、y、z、w的物质的量的变化情况
,则所发生反应的化学方程式是( )
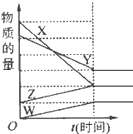
A. 4x+2y
z+w B. 6x+5y
4z+w
C. 3w+z
4x+2y D. 2x+y
2z+2w
难度: 中等查看答案及解析
-
一定温度下,反应A2(g)+B2(g)
2AB(g)达到平衡的标志是
A. 单位时间内生成n mol A2的同时生成n mol AB
B. 容器内的总压强不随时间的变化而变化
C. 单位时间内生成2n mol AB的同时生成n mol B2
D. 单位时间内生成n mol A2的同时生成n mol B2
难度: 简单查看答案及解析
-
已知反应CH4(g)+CO2(g)
2CO(g)+2H2(g) ΔH>0,有利于提高CH4平衡转化率的条件是
A. 高温低压 B. 低温高压 C. 高温高压 D. 低温低压
难度: 简单查看答案及解析
-
在密闭容器中发生下列反应 aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是
A. A的转化率变小 B. 平衡向正反应方向移动
C. D的物质的量变多 D. a>c+d
难度: 中等查看答案及解析
-
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
CO(g)+H2O(g),
K为化学平衡常数,其中K和温度的关系如下表:
t/℃
700
800
830
1 000
1 200
K
0.6
0.9
1.0
1.7
2.6
根据以上信息推断以下说法正确的是
A. 此反应为放热反应
B. 此反应只有达到平衡时,密闭容器中的压强才不会变化
C. 此反应达到1 000℃时的反应速率比700℃时大
D. 该反应的化学平衡常数越大,反应物的转化率越低
难度: 简单查看答案及解析
-
化学与生活密切相关,下列与盐类水解无关的是
A. 纯碱去油污 B. 食醋除水垢 C. 明矾净化水 D. NH4Cl除铁锈
难度: 简单查看答案及解析
-
下列溶液一定呈中性的是
A. pH=7的溶液
B. c(H+)=c(OH-)=10-6 mol·L-1的溶液
C. c(H+)水=c(OH-)水的溶液
D. 酸与碱恰好完全反应生成正盐的溶液
难度: 简单查看答案及解析
-
用0.102 6 mol·L-1的盐酸滴定25.00 mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )

A. 22.30 mL B. 22.35 mL C. 23.65 mL D. 23.70 mL
难度: 简单查看答案及解析