-
用一定方法可除去下列物质中所含的少量杂质(括号内为杂质),其中所选试剂均足量且能达到除杂目的的是
A. NaCl溶液(I2):CCl4 B. Na2CO3(NaHCO3):盐酸
C. CO(SO2):Na2CO3溶液 D. FeCl2(FeCl3):Cl2
难度: 简单查看答案及解析
-
“纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质 ①是溶液 ②是胶体 ③能产生丁达尔效应 ④不能透过滤纸 ⑤能透过滤纸 ⑥静置后会析出黑色沉淀
A. ①④⑤ B. ②③④ C. ②③⑤ D. ①③④⑥
难度: 简单查看答案及解析
-
化学与生产生活密切相关,下列叙述错误的是
A. 用食醋可除去热水壶内壁的水垢
B. 利用纳米铁粉的物理吸附作用除去水体中的Cu2+、Hg2+等重金属离子
C. 大量燃烧化石燃料是造成雾霾天气的一种重要因素
D. 高纯度的二氧化硅广泛用于制造光导纤维,光导纤维遇强碱会“断路”
难度: 简单查看答案及解析
-
近期埃博拉病毒在非洲各国肆虐,严重威胁了非洲人民的生命。在此期间,环境消毒是极其关键的,常常喷洒一种名为“84”的消毒液,其有效成分为NaClO。下列有关“84”消毒液的说法正确的是
A. “84”的消毒液属于纯净物
B. “84”的消毒液除能杀菌消毒外,还可作漂白剂
C. “84”消毒液中的NaClO比较稳定,不需密封保存
D. “84”消毒液杀菌消毒过程中并未发生氧化还原反应
难度: 简单查看答案及解析
-
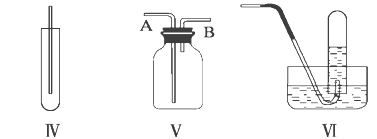
化学实验中很多气体是用盐酸来制取的,因此制取的气体中常含有HCl杂质。下列气体可用如图所示装置除去HCl杂质的是
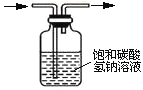
A. H2 B. Cl2 C. O2 D. CO2
难度: 中等查看答案及解析
-
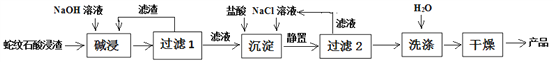
以下实验装置一般不用于分离物质的是
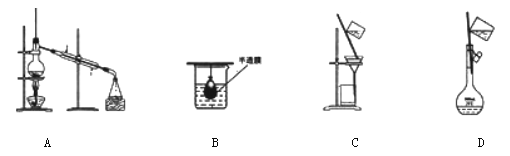
难度: 简单查看答案及解析
-
实验室需用480 mL 0.1 mol·L-1 的硫酸铜溶液,以下操作能配制成功的是
A. 称取7.68 g CuSO4粉末,加入500 mL水,选取500 mL容量瓶进行配制
B. 称取12.5 g CuSO4·5H2O晶体,加水配成500 mL溶液,选取500 mL容量瓶进行配制
C. 称取8.0 g CuSO4粉末,加入480 mL水,选取480 mL容量瓶进行配制
D. 称取8.0 g CuSO4·5H2O晶体,加水配成480 mL溶液,选取480 mL容量瓶进行配制
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 次氯酸钠溶液中通入过量二氧化硫:ClO- + H2O + SO2 = HClO+ HSO3-
B. 向碳酸氢钠溶液中加入过量氢氧化钙溶液:2HCO3-+ Ca2++2OH-= CaCO3↓+2H2O+CO32-
C. 氢氧化钡溶液与硫酸溶液反应得到中性溶液:Ba2++OH-+ H++SO42—= BaSO4↓+H2O
D. 50 mL 1mol/L的FeBr2溶液中通入0.05 molCl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
难度: 中等查看答案及解析
-
m molCu2S与足量的稀硝酸反应,生成Cu(NO3)2、H2SO4、NO和H2O。则被还原的HNO3的物质的量为
A. 4m mol B. 10m mol C. 10m/3 mol D. 2m/3mol
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法不正确的是
A. 8.8g由CO2和N2O组成的混合气体中含有的原子总数为0.6NA
B. 4.6gNa与氧气完全反应生成Na2O,转移的电子数为0.4NA
C. 7.8g由Na2S和Na2O2 组成的混合物中含有的阴离子数为0.1NA
D. 5.6g铁粉在0.1mol氯气中充分燃烧,转移的电子数为0.2NA
难度: 简单查看答案及解析
-
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是
A. FeO B. Fe2O3 C. Fe3O4 D. FeSO4
难度: 简单查看答案及解析
-
下列各组离子在相应的条件下一定能大量共存的是
A. 在碱性溶液中:CO32﹣、K+、S2﹣、Na+
B. 与铝粉反应放出氢气的无色溶液中:NO3﹣、Mg2+、Na+、SO42﹣
C. 使pH试纸变红的溶液中:NH4+、AlO2﹣、C1﹣、K+
D. 在无色澄清溶液中:K+、C1﹣、A13+、 NO3﹣ MnO4-
难度: 简单查看答案及解析
-
下列实验操作及现象和结论相符的是
选项
实验操作及现象
结论
A
向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体
溶液中一定含有CO32-
B
向某溶液中加入硝酸银,产生白色沉淀
溶液中一定含有Cl-
C
用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色
溶液中有Na+,无K+
D
向某溶液中先滴加几滴KSCN溶液,无明显现象,再滴加氯水,溶液变红
溶液中一定含有Fe2+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列离子方程式的书写及评价均合理的是( )
选项
离子方程式
评价
A
将2 mol Cl2通入含1 mol FeI2的溶液中:
2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2
正确;Cl2过量,可将Fe2+、I-均氧化
B
Ba(HCO3)2溶液与足量的NaOH溶液反应:
Ba2++HCO3-+OH-===BaCO3↓+H2O
正确;酸式盐与碱反应生成正盐和水
C
过量SO2通入NaClO溶液中:
SO2+H2O+ClO-===HClO+HSO3-
正确;说明酸性:H2SO3强于HClO
D
1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合:
2AlO2-+5H+===Al3++Al(OH)3↓+H2O
正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
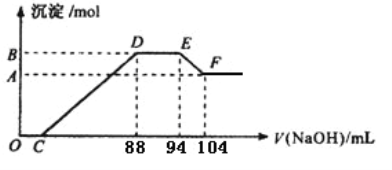
向一定量的明矾溶液中滴加Ba(OH)2溶液,生成沉淀的质量m与加入Ba(OH)2溶液的体积V之间的关系正确的是
A.
 B.
B. 
C.
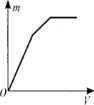 D.
D. 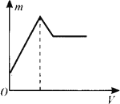
难度: 中等查看答案及解析
-
取36克某铁矿石(只含铁的氧化物和SiO2)溶于过量的稀盐酸中,经过滤、洗涤、干燥后得到5.6g不溶物。向得到的滤液中加入足量的NaOH溶液,过滤、洗涤后将沉淀灼烧,得32g红棕色固体。下列结论不正确的是
A. 由铁矿石转化为红棕色固体的过程中发生了氧化还原反应
B. 铁矿石溶于盐酸后得到的滤液中:n(Fe2+):n(Fe3+)=1:1
C. 铁矿石中铁的氧化物的化学式为Fe3O4
D. 36g该铁矿石与1mol·L-1的稀盐酸恰好完全反应时,消耗盐酸的体积为1L
难度: 中等查看答案及解析