-
化学与生活密切相关。下列应用中利用了物质氧化性的是( )
A. 明矾净化水 B. 纯碱去油污
C. 食醋除水垢 D. 漂白粉漂白织物
难度: 中等查看答案及解析
-
钢铁发生吸氧腐蚀时,正极上发生的电极反应是
A. 2H+ + 2e- = H2↑ B. Fe2+ + 2e- = Fe
C. 2H2O + O2 + 4e- = 4OH- D. Fe - 2e- = Fe2+
难度: 简单查看答案及解析
-
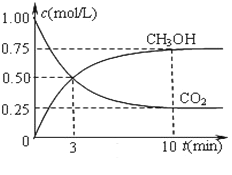
1克氢气燃烧生成液态水放出142.9 kJ热,表示该反应的热化学方程式正确的是
A. 2H2(g) + O2(g) = 2H2O(l); △H = —142.9 kJ/mol
B. H2(g) + 1/2O2(g) = H2O(l); △H = —285.8 kJ/mol
C. 2H2 + O2 = 2H2O; △H = —571.6 kJ/mol
D. H2(g) + 1/2O2(g) = H2O(g);△H = —285.8kJ/mol
难度: 中等查看答案及解析
-
下列说法正确的是
A. 原电池是把电能转化为化学能的装置
B. 原电池的负极和电解池的阳极上都发生氧化反应
C. 形成原电池后,阳离子通过盐桥向负极移动
D. 电解时,电解池的阳极一定是阴离子放电
难度: 中等查看答案及解析
-
100mL2mol/LH2SO4跟过量锌粉反应,在一定温度,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
A. 碳酸钠(固体) B. 水 C. 硝酸钾溶液 D. 硫酸铵(固体)
难度: 简单查看答案及解析
-
在气体反应中,能使反应物中活化分子数和活化分子百分数同时增加的方法是
①增大反应物浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A. ① ③ B. ② ⑤ C. ② ④ D. ① ⑤
难度: 简单查看答案及解析
-
下列离子方程式中正确的是
A. 氯气与水反应:Cl2+H2O
2H++ClO-+Cl-
B. 铁与稀硫酸反应:2Fe +6H+ =2Fe3++3H2↑
C. 铅蓄电池放电时的正极反应: PbO2+4H++SO42-+2e- = PbSO4+2H2O
D. 用铜电极电解硫酸铜溶液:2Cu2++2H2O = 2Cu+O2↑+4H+
难度: 简单查看答案及解析
-
下列化学反应中:Ag++Fe2+
Ag(固)+Fe3+(正反应放热)为使平衡体系析出更多的银,可采取的措施是
A. 常温下加压 B. 增加Fe3+的浓度
C. 增加Fe2+的浓度 D. 移去一些析出的银
难度: 简单查看答案及解析
-
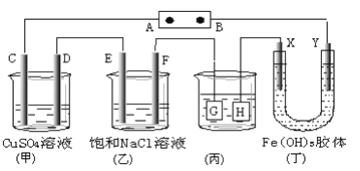
某学生欲完成反应Cu+H2SO4===CuSO4+H2↑而设计了下列四个实验,你认为可行的是
A.
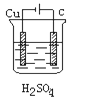 B.
B. 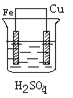 C.
C.  D.
D. 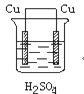
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 能溶解Al2O3 的溶液:Na+、K+、HCO3-、NO3-
B. 0.1mol·L-1Ca(ClO)2 溶液:K+、Na+、I-、Cl-
C. 能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO3-
D. 加入KSCN 显红色的溶液:Na+、Mg2+、Cl-、SO42-
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列判断正确的是
A. 18gD2O含有的分子数目为NA
B. 常温常压下,22.4LCO2含有的分子数目为NA
C. 1L1mol·L-1 KOH溶液中含有的钾离子数目为NA
D. 1molCl2溶于水充分反应转移的电子数目为NA
难度: 中等查看答案及解析
-
次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性,下列有关说法正确的是
A. H3PO2溶于水的电离方程式为:H3PO2
3H++PO23-
B. H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C. 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的氧化产物为H3PO4
D. 用惰性电极电解NaH2PO2溶液,其阳极反应式为:H2PO2--4e-+2H2O=O2+6H++PO23-
难度: 中等查看答案及解析
-
下列说法正确的是
A. 硫酸氢钾在熔融状态下离子键、共价键均被破坏,形成定向移动的离子,从而导电
B. F2、Cl2、Br2、I2的熔沸点逐渐升高,是因为分子间作用力越来越大
C. NH3和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D. HF、HCl、HBr、HI的稳定性逐渐减弱,其熔沸点逐渐升高
难度: 中等查看答案及解析
-
某恒定温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)
4C(?)+2D(?),“?”代表状态未定。反应一段时间后达到平衡,测得生成1. 6 mol C,且反应前后压强之比为5∶4,则下列说法正确的是
A. 该反应的化学平衡常数表达式是K= c4(C).c2(D)/[c3(A).c2(B)]
B. 此时B的平衡转化率是35%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 平衡后再增加1mol C,B的平衡转化率不变
难度: 中等查看答案及解析