-
短周期元素 W、X、Y 和 Z 的原子序数依次增大,元素 W 原子的最外层电子数与内层电子数相等,X 原子的最外层电子数是内层电子数的 2 倍,元素 Y 是地壳中含量最丰富的金属元素,Z 原子的最外层电子数是其电子层数的 2 倍。下列说法错误的是
A. 元素 Z 的最高价氧化物的水化物,在一定条件下可与 X 的单质发生反应
B. 元素 X 与元素 Z 均可形成含 18 个电子的气态氢化物
C. 元素 Y 的简单离子的半径小于 Z 的简单离子的半径,且二者在水溶液中不能大量共存
D. 元素 W、X 的氯化物中,各原子均满足 8 电子的稳定结构
难度: 中等查看答案及解析
-
《本草纲目》中的“石碱”条目中写道:“采蒿蓼之属,晒干烧灰,以水淋汁,……浣衣发面,甚获利也”。这里的“石碱”是指( )
A. KOH B. KAl(SO4)2
C. KHCO3 D. K2CO3
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 含0.1 mol Na2O2的晶体中阳离子与阴离子总数为0.4NA
B. 46g NO2和N2O4的混合气体中含有的氧原子数介于2NA与4NA之间
C. 常温下,100ml0.5mo1·L‑1盐酸与2.3g钠反应生成H2分子数为0.05NA
D. 标准状况下,22.4 LSO3与水反应生成1molH2SO4
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A. 澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. 酸性高锰酸钾溶液与稀草酸反应:5C2O42-+2MnO4-+16H+===2Mn2++10CO2+8H2O
C. AgCl的悬浊液中滴加Na2S溶液:2AgCl+S2-===Ag2S+2Cl-
D. NH4HCO3溶液加入过量NaOH溶液加热:NH4++OH-===NH3•H2O
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是( )
选项
操作
现象
结论
A
铝片先用砂纸打磨,再加入到浓硝酸中
无明显现象
浓硝酸具有强氧化性,常温下铝被浓硝酸钝化
B
①某溶液中加入Ba(NO3)2溶液,②再加入足量盐酸
①产生白色沉淀
②仍有白色沉淀
原溶液中有SO42-
C
某溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
原溶液中有Fe2+,
无Fe3+
D
向蔗糖中加入浓硫酸
蔗糖变成疏松多孔的海绵状碳并产生刺激性气味
浓硫酸具有吸水性和强氧化性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
锌溴液流电池是一种新型电化学储能装置(如下图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法正确的是( )
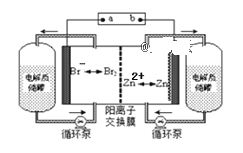
A. 充电时阴极的电极反应式为:Br2+2e-=2Br-
B. 放电时每转移2mol电子,负极区质量减少65克
C. 放电时左侧电解质储罐中的离子总浓度增大
D. 充电是b接电源的正极,Zn2+通过阳离子交换膜由左侧流向右侧
难度: 中等查看答案及解析
-
700℃时,H2(g)+CO2(g)
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v (H2O)为0.025 mol/(L·min),下列判断不正确的是( )
起始浓度
甲
乙
丙
C(H2)/mol/L
0.1
0.2
0.2
C(CO2)/mol/L
0.1
0.1
0.2
A. 平衡时,乙中CO2的转化率大于50%
B. 当反应平衡时,丙中c(CO2)是甲中的2倍
C. 温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同
难度: 中等查看答案及解析