-
在密闭容器中A与B反应生成C,其反应速率分别用v (A)、v (B)、v (C)表示。已知v (A)、v (B)、v (C)之间有以下关系2 v (B)=3 v (A), 3 v (C)=2 v (B)。 则此反应可表示为( )
A. 2A + 3B = 2C B. A+ 3B = 2C
C. 3A + B = 2C D. A + B = C
难度: 简单查看答案及解析
-
250℃和1.01×105 Pa时, 2N2O5(g) = 4NO2(g) + O2(g) △H= +56.76 kJ/mol,该反应能自发进行的原因是( )
A. 是吸热反应 B. 是放热反应 C. 是熵减少的反应 D. 熵增大效应大于焓效应
难度: 简单查看答案及解析
-
下列说法或表示方法正确的是( )
A. 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多
B. 由C(石墨)=C(金刚石) ΔH= +11.9 kJ/mol,可知金刚石比石墨稳定
C. 水力(水能)按不同的分类可看成可再生能源和一级能源
D. 表示氢气燃烧热的热化学方程式为H2(g)+1/2O2(g)=H2O(g) ΔH= -241.8 kJ/mol
难度: 简单查看答案及解析
-
下列方法对2SO2(g)+O2(g)
2SO3(g)的反应速率没有影响的是( )
A. 加入SO3 B. 容积不变,充入N2气体 C. 压强不变,充入N2气体 D. 降低温度
难度: 简单查看答案及解析
-
下图曲线a表示放热反应X(g)+Y(g)
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
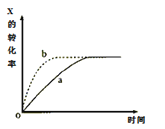
A. 减小体积 B. 加大X的投入量
C. 减压 D. 升高温度
难度: 中等查看答案及解析
-
下列各组物质,按强电解质、弱电解质、非电解质、既不是电解质又不是非电解质的顺序排列的是
A. NaOH、NaCl、SO2、NaCl溶液 B. BaSO4、SO3、CuSO4晶体、Na2O2
C. NaCl、H2S、CO2、Cu D. SO3、AgCl、NH3•H2O、Ag
难度: 简单查看答案及解析
-
可逆反应aA(s)+bB(g)
cC(g) +dD(g), 当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,以下正确的是( )
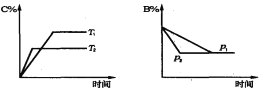
A. T1>T2,正反应放热
B. Tl<T2,正反应吸热
C. P1>P2,a+b>c+d
D. Pl<P2,b=c+d
难度: 中等查看答案及解析
-
一定条件下,可逆反应C(s) + CO2(g)
2CO(g) △H>0,达到平衡状态,现进行如下操作:①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是( )
A. ①②③④ B. ①③ C. ①②③ D. ①③④
难度: 中等查看答案及解析
-
在水中存在 H2O
H++OH-平衡,加入下列哪种物质或进行哪项操作,不会使平衡发生移动
A. 加入NaOH B. 加入CH3COOH C. 加入NaCl D. 升温
难度: 简单查看答案及解析
-
在含有酚酞的0.1mol·L-1氨水中加入少量的NH4Cl晶体,溶液颜色
A. 变蓝色 B. 变深 C. 变浅 D. 不变
难度: 简单查看答案及解析
-
对于可逆反应:2A(g)+B(g)
2C(g) △H<0,下列各图中正确的是( )
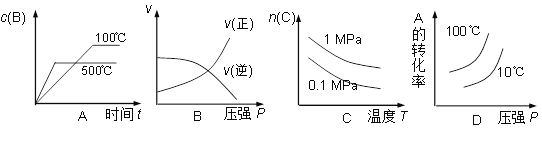
难度: 困难查看答案及解析
-
在2A+B
3C+4D反应中,表示该反应速率最快的是( )
A. υ(A)= 0.5 mol/(L·s) B. υ(B)= 18 mol/(L·min)
C. υ(C)= 0.8 mol/(L·s) D. υ(D)= 1 mol/( L·s)
难度: 简单查看答案及解析
-
下列电离方程式中,正确的是
A. CH3COOH = CH3COO- + H+ B. NaOH = Na+ + OH-
C. KClO3
K+ + ClO3- D. BaSO4 = Ba2+ + S2- +4O2-
难度: 简单查看答案及解析
-
下列 物质中既能导电又属于强电解质的一组物质是( )
A. 熔融的MgCl2和熔融的NaOH B. 液氨 和石灰水
C. 石墨和食醋 D. 稀硫酸和蔗糖
难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A. C2H5OH(l)+3O2(g)
2CO2(g)+3H2O(g) ΔH=−1 367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)
NaCl(aq)+H2O(l) ΔH=+57.3 kJ/mol(中和热)
C. S(s)+O2(g)
SO2(g) ΔH=−296.8 kJ/mol(反应热)
D. 2NO2
O2+2NO ΔH=+116.2 kJ/mol(反应热)
难度: 中等查看答案及解析
-
关于溶液酸碱性的说法正确的是
A. c(H+)很小的溶液一定是中性 B. pH=7的溶液一定呈中性
C. c(H+)=c(OH-)溶液一定呈中性 D. 不能使酚酞试液变红的溶液一定呈酸性
难度: 简单查看答案及解析
-
下列反应既属于氧化还原反应,又属于吸热反应的是( )
A. 铝片和稀盐酸反应 B. Ba(OH)2·8H2O与NH4Cl的反应
C. 灼热的碳与二氧化碳的反应 D. 甲烷在氧气中的燃烧
难度: 简单查看答案及解析
-
下列说法正确的是
A. 电离平衡常数受溶液浓度的影响
B. 温度一定时,电离平衡常数可以表示弱电解质的相对强弱
C. 电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大
D. H2CO3第二步的电离常数表达式:K2=c(H+)·c(H2CO3-)/c(H2CO3)
难度: 中等查看答案及解析