-
化学与生产和生活密切相关。下列过程中没有发生化学变化的是( )
A. 氯气作水杀菌消毒剂
B. 硅胶作袋装食品的干燥剂
C. 二氧化硫作纸浆的漂白剂
D. 肥皂水作蚊虫叮咬处的清洗剂
难度: 简单查看答案及解析
-
向新制氯水中加入少量下列物质,能增强溶液漂白能力的是( )
A. 碳酸钙粉末 B. 稀硫酸 C. 氯化钙溶液 D. 二氧化硫水溶液
难度: 中等查看答案及解析
-
下列说法中正确的是
A. Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
B. 小苏打是制作面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂
C. C、Si、S都是自然界中含量丰富的非金属元素,三种元素的二氧化物都属于酸性氧化物,故均能与碱反应而不能与酸反应
D. 碱性氧化物都是由金属元素和氧元素组成,如Na2O2、Mn2O7、Fe2O3都为碱性氧化物
难度: 中等查看答案及解析
-
下列表示物质结构的化学用语正确的是 ( )
A. HF的电子式:
B. HClO的结构式:H—O—Cl
C. S2-的结构示意图:
D. CaO的俗名:熟石灰
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 1 L pH=1的稀硫酸中有0.2NA个H+
B. 1 L 0.1 mol·L-1 NaHCO3溶液中HCO3-数为0.1NA
C. 标准状况下,22.4 L氯仿(三氯甲烷)中共价键数目为4NA
D. 23 g钠充分燃烧时转移电子数为NA
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是 ( )
A. FeO溶于稀硝酸:FeO+2H+
Fe2++H2O
B. Al2(SO4)3溶液中加入过量Ba(OH)2溶液:Al3++4OH-
AlO2-+2H2O
C. 漂白粉溶液中通入少量CO2: 2ClO-+H2O+CO2
2HClO+CO32-
D. 向NaOH溶液中滴加过量Ca(HCO3)2溶液:Ca2++HCO3-+OH-
CaCO3↓+H2O
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A. pH=1的溶液中:Ba2+、Fe3+、Cl-、SCN-
B. 能使酚酞溶液变红的溶液中:Ca2+、K+、HCO3-、CO32-
C. c(OH-)/c(H+)=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D. 水电离产生的c(OH-)=10-12 mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
难度: 困难查看答案及解析
-
硫酸亚铁煅烧反应为2FeSO4(s)
SO2(g)+Fe2O3(s)+SO3(g),有关说法正确的是 ( )
A. 该反应中每生成1 mol Fe2O3转移电子数约为1×6.02×1023
B. SO2能使溴水褪色,说明SO2具有漂白性
C. 该反应中FeSO4既作氧化剂又作还原剂
D. 该反应生成的气体通入足量BaCl2溶液中,可得到BaSO3和BaSO4两种沉淀
难度: 中等查看答案及解析
-
从石英砂制取并获得高纯硅的主要化学反应如下:
①SiO2+2C
Si(粗)+2CO↑
②Si(粗)+2Cl2
SiCl4
③SiCl4+2H2
Si(纯)+4HCl
关于上述反应的分析不正确的是( )
A. ①、③是置换反应,②是化合反应
B. 任一反应中,每消耗或生成28 g硅,均转移4 mol电子
C. 高温下,焦炭与氢气的还原性均强于硅
D. 高温下将石英砂、焦炭、氯气、氢气按一定比例混合可得高纯硅
难度: 困难查看答案及解析
-
从海带中提取碘单质,成熟的工艺流程如下:
干海带
海带灰

滤液
碘水
I2的CCl4溶液
I2
下列关于海带制碘的说法正确的是( )
A. 实验室可在蒸发皿中灼烧干海带,并用玻璃棒不断搅拌
B. 向含I-的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应
C. 在碘水中加入几滴淀粉溶液,溶液变蓝色
D. 向碘水中加入CCl4得到I2的CCl4溶液,该操作为萃取,可用乙醇代替CCl4
难度: 中等查看答案及解析
-
海水开发利用的部分过程如图所示。下列说法错误的是
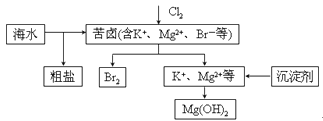
A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
难度: 中等查看答案及解析
-
下列说法正确的是
A. 用湿润的pH试纸测定NaCl 溶液的pH时会影响测定结果
B. 检验某溶液含有NH4+:取试样少许于试管中,加入足量NaOH溶液加热,用湿润红色石蕊试纸检验变蓝
C. 液溴保存时液面覆盖一层水,装在带橡胶塞的细口试剂瓶中
D. 配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就定容,所配制的溶液浓度偏小
难度: 中等查看答案及解析
-
关于如下图进行的实验的说法,正确的是( )
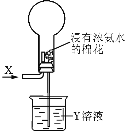
A.若X为HCl,则烧瓶内可产生白雾
B.选择适当的X和Y溶液可产生有色喷泉
C.若烧瓶内产生喷泉,则Y溶液一定呈酸性
D.若通入气体为Cl2,则烧瓶内一定无喷泉产生
难度: 中等查看答案及解析
-
由下列实验现象一定能得出相应结论的是
选项
A
B
C
D
装置图
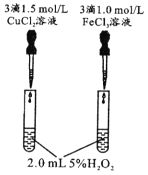
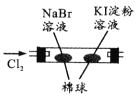
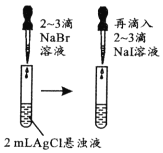
现象
右边试管产生气泡较快
左边棉球变棕黄色,右边棉球变蓝色
试管中先出现淡黄色固体,后出现黄色固体
试管中液体变浑浊
结论
催化活性:Fe3+>Cu2+
氧化性:Br2>I2
Ksp:AgCl>AgBr>AgI
非金属性:C>Si
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
选项
a
b
c
A
Al
AlCl3
Al(OH)3
B
CO2
Na2CO3
NaHCO3
C
Si
SiO2
H2SiO3
D
S
SO3
H2SO4
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 硫酸钡俗称钡餐,用作胃肠造影剂
B. 铁能与氯化铜溶液反应,该反应可以应用于印刷电路板的制作
C. 二氧化硅常用于制造光导纤维
D. 溴化银是一种重要的感光材料,是胶卷必不可少的部分
难度: 中等查看答案及解析
-
高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场 “革命”。它的制备方法如下图所示,下列说法正确的是
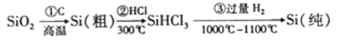
A. 步骤①的化学方程式为:SiO2+C
Si+CO2↑
B. 灼烧熔融的Na2CO3固体,可用石英坩埚
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点67.6℃),可通过蒸馏(或分馏)提纯SiHCl3
难度: 中等查看答案及解析
-
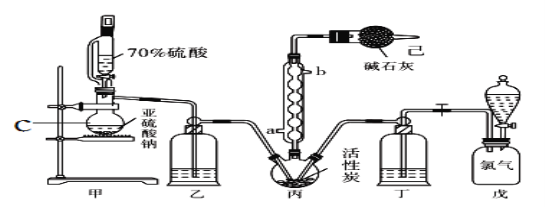
某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是( )

A. 装置A气密性的检查方法:直接向长颈漏斗中加水,当漏斗中液面高于试管中液面且高度不变说明气密性良好
B. 装置B中盛放浓硫酸,目的是除去A中挥发出来的少量水蒸气
C. 装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D. 装置A也可直接用于Cu与浓硫酸反应制取SO2
难度: 中等查看答案及解析
-
生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液pH、n[Al(OH)3]随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法不正确的是
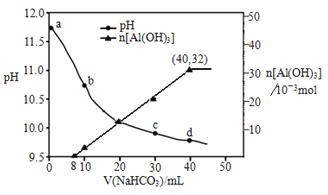
A. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
B. b 点与c点溶液所含微粒种类相同
C. a 点溶液中大量存在的离子是Na+、AlO2-、OH-
D. NaHCO3溶液的物质的量浓度为0.8mol/L
难度: 困难查看答案及解析
-
向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中c(SO32-)/c(Fe3+)变化的曲线如图所示。实验发现:
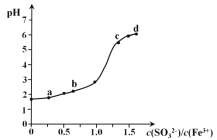
i. a点溶液透明澄清,向其中滴加NaOH溶液后,立即产生灰白色沉淀,滴入KSCN溶液显红色;
ii. c点和d点溶液中产生红褐色沉淀,无气体逸出。取其上层清液滴加NaOH溶液后无明显现象,滴加KSCN溶液显红色。下列分析合理的是
A. 向a点溶液中滴加BaCl2溶液,无明显现象
B. b点较a点溶液pH升高的主要原因:2Fe3+ + SO32- + H2O === 2Fe2+ + SO42- + 2H+
C. c点溶液中发生的主要反应:2Fe3+ + 3SO32- + 6H2O
2Fe(OH)3↓+ 3H2SO3
D. 向d点上层清液中滴加KSCN溶液,溶液变红;再滴加NaOH溶液,红色加深
难度: 中等查看答案及解析