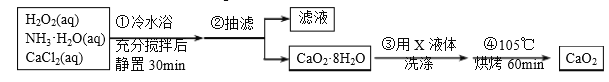
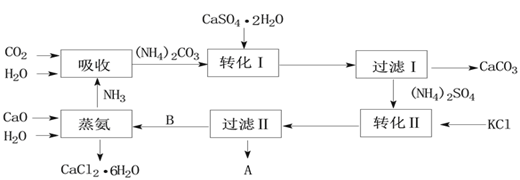
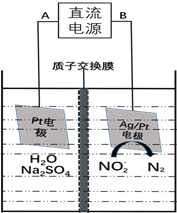
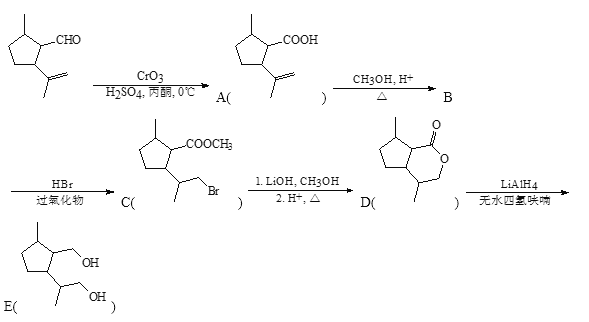
-
室温时,下列各溶液的叙述中正确的是
A. 将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,析出的AgCl沉淀少于AgBr沉淀
B. 已知酸性:HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-) ]
C. 0.1mol/L的氨水的pH=a,0.01mol/L的氨水的pH=b,则a-1>b
D. 0.10mol·L-1CH3COONa溶液中通入HCl至溶液的pH恰好等于7,则c(Na+)>c(CH3COOH)=c(Cl-)
难度: 中等查看答案及解析
-
设N A为阿伏加德罗常数,下列说法不正确的是
A. 32 g S8单质中含有的S—S键个数约为6.02×1023
B. 12.4g白磷中含有磷原子数为0.4NA
C. 常温常压下,1 mol氦气含有的核外电子数为4 NA
D. 0.1molOH-含NA个电子
难度: 简单查看答案及解析
-
下列实验现象或结论判断错误的是( )
A. 向Ca(OH)2和NaAlO2的混合溶液中通入CO2气体至过量,最终得到一种沉淀
B. 向Na2CO3和NaHCO3的混合溶液中逐滴加入盐酸,一滴入盐酸马上产生CO2气体
C. 不法商贩使用明矾与小苏打炸油条的化学原理与泡沫灭火器工作的化学原理类似
D. 向CuSO4和FeCl3的混合溶液中加入过量氨水,只产生红褐色沉淀
难度: 中等查看答案及解析
-
下列说法中错误的是
A. 合成纤维的“六大纶”都可以用聚合反应制备
B. 不能用燃烧法鉴别环己烷、苯、CCl4
C. 使用国际通行的凯氏定氮法测定奶粉中的蛋白质含量时,会把三聚氰胺当做蛋白质而导致测定结果偏高
D. 蓝矾、明矾、石膏、芒硝都是硫酸盐的结晶水合物
难度: 中等查看答案及解析
-
X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是
A. X元素的氢化物的水溶液显碱性
B. Z元素的离子半径大于W元素的离子半径
C. Z元素的单质在一定条件下能与X元素的单质反应
D. Y元素最高价氧化物的晶体具有很高的熔点和沸点
难度: 困难查看答案及解析
-
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图)。其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
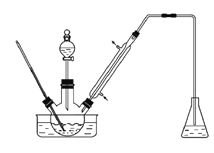
下列说法错误的是
A. 甲同学认为步骤1中使用1,2-二氯乙烷的目的是做催化剂,加快反应速率
B. 乙同学认为可在该实验装置的冷凝管后加接一只装有无水MgSO4的干燥管,实验效果可能会更好
C. 丙同学认为步骤2中有机相使用10%NaHCO3溶液洗涤可除去大部分未反应完的Br2
D. 丁同学认为步骤4中减压蒸馏有机相是因为间溴苯甲醛高温下容易氧化或分解
难度: 简单查看答案及解析
-
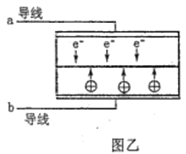
LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池的装置示意图,图乙是LED发光二极管的装置示意图。下列叙述错误的是( )
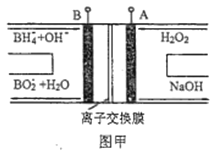
A. 电池应选用阳离子交换膜,Na+向A极区移动
B. 电池A极区的电极反应式为:H2O2+2e-=2OH-
C. 每有1 molNaBH4参加反应,转移电子数为4NA
D. 要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连
难度: 中等查看答案及解析