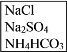-
使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②有些固体溶解会放热,若未经冷却即转移至容量瓶
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A. ①③⑤⑥ B. ①②⑤⑥ C. ②③④⑥ D. ③④⑤⑥
难度: 简单查看答案及解析
-
今有下列三个氧化还原反应:①2FeCl3+2KI = 2FeCl2+2KCl+I2 ②2FeCl2+Cl2 = 2FeCl3 ③2KMnO4+16HCl(浓) =2KCl+2MnCl2+8H2O+5Cl2↑。若某溶液中有Fe2+和I—共存,要氧化除去I—而又不影响Fe2+,可加入的试剂是
A. Cl2 B. KMnO4 C. FeCl3 D. FeCl2
难度: 简单查看答案及解析
-
已知用金属钠生成氧化钠,可有多种方法:①4Na+O2 = 2Na2O,
②4Na+CO2 = 2Na2O+C ③2NaNO2(亚硝酸钠)+6Na = 4Na2O+N2↑,下列说法错误的是
A. 三个反应都属于氧化还原反应
B. ①方法产物中可能混有过氧化钠
C. ②方法中固体产物中的碳可在空气中灼烧除去
D. ③方法中副产物氮气可以保护Na2O不易被氧化
难度: 中等查看答案及解析
-
下列叙述正确的是( )
①Na在空气中放置最终变为NaOH ②Na在空气中燃烧,产物是Na2O
③将一块铝箔用砂纸打磨表面后,在酒精灯上加热至熔化但不滴落,说明Al2O3的熔点比铝高
④镁因在空气中形成了一层致密的氧化物薄膜,保护了里面的镁,故镁不像钠那样需要特殊的保护
⑤铝制品在生活中应用非常普遍,是因为铝不活泼
⑥铁在潮湿的空气中生成的氧化物不致密,不能保护内层金属,故铁制品往往需涂保护层
⑦钠与水的反应中钠块熔成小球说明该反应为放热反应
A. ①③⑤⑥ B. ②③④ C. ①②④⑤ D. ③④⑥⑦
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述中正确的是( )
A. 标准状况下,22.4 L H2O含有的分子数为NA
B. 常温常压下,1.06 g Na2CO3含有的Na+数为0.02NA
C. 常温常压下,NA个CO2分子占有的体积为22.4 L
D. 物质的量浓度为0.5 mol•L﹣1的MgCl2溶液中含有Cl﹣个数为NA
难度: 中等查看答案及解析
-
把V L含有MgS04和K2S04的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
A.mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
难度: 简单查看答案及解析
-
以下关于化学实验中“先”与“后”的说法正确的是
①加热试管时,先均匀加热,后局部加热 ②做H2还原CuO实验时,先通H2,后加热CuO,反应完毕后,先撤酒精灯待试管冷却,后停止通H2 ③制取气体时,先检查装置气密性,后装药品 ④点燃可燃性气体如H2、CO等时,先检验气体纯度,后点燃 ⑤制取蒸馏水时,先通冷却水,后加热蒸馏烧瓶 ⑥进行分液操作时,先从上口倒出上层液体,后从通过下端活塞放出下层液体
A. ①②③④ B. ①②③④⑤ C. ①②③④⑥ D. 全部
难度: 困难查看答案及解析
-
在烧杯中加入水和苯(苯的密度为 0.88 g·cm-3,与水互不相溶,且不与钠反应)各 50 mL,将一小 粒金属钠(密度为 0.97 g·cm-3)投入烧杯中,观察到的现象可能为
A. 钠在水层中反应并四处游动 B. 钠停留在苯层中不发生反应
C. 钠在苯的液面上反应并四处游动 D. 钠在苯与水的界面处与水反应并可能上下跳动
难度: 中等查看答案及解析
-
己知金属钾投入水中会发生剧烈反应,并有氢气生成。运输金属钾的包装箱应贴有的图标是( )
A. 易燃液体
 B. 遇湿易燃物品
B. 遇湿易燃物品
C. 氧化剂
 D. 腐蚀品
D. 腐蚀品
难度: 简单查看答案及解析
-
在无色溶液中,能大量共存的离子组是( )
A. K+、Ca2+、CO32-、Cl- B. Na+、Cu2+、Br-、Ba2+
C. K+、MnO4-、NO3-、Na+ D. Na+、SO32-、SO42-、K+
难度: 简单查看答案及解析
-
已知Fe3O4可以表示成FeO· Fe2O3。水热法制备Fe3O4纳米颗粒的反应为:3Fe2++2S2O32-+O2+4OH-= Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A. Fe2+是还原剂,S2O32-和O2是氧化剂
B. 每生成1mol Fe3O4反应转移的电子数为2mol
C. 若有2mol Fe2+被氧化,被Fe2+还原的O2为0.5mo1
D. 将纳米Fe3O4分散在水中,Fe3O4不能透过滤纸
难度: 中等查看答案及解析
-
下列叙述中正确的是 ( )
A. FeCl3溶液、Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是有没有丁达尔效应
B. 根据分散系的稳定性大小将混合物分为胶体、溶液和浊液
C. 将几滴汽油加入装有10mL水的试管中,用力振荡形成胶体
D. 胶体、分散系、混合物概念间的从属关系可用图表示
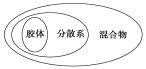
难度: 简单查看答案及解析
-
镁和铝分别与等浓度、等体积的足量稀硫酸反应,相同条件下产生气体的体积(V)与时间(t)关系如图。反应中镁和铝的( )

A. 物质的量之比为3:2 B. 质量之比为3:2
C. 转移电子数之比为3:2 D. 气体的体积之比为2:3
难度: 中等查看答案及解析
-
同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是( )
①分子个数之比为11:16 ②密度比为11: 16 ③体积比为16:11 ④原子个数比为11:16
A. ①④ B. ①③ C. ②③ D. ②④
难度: 中等查看答案及解析
-
等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是( )
A. 甲、乙中都是铝过量
B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量
D. 甲中酸过量,乙中碱过量
难度: 中等查看答案及解析
-
将Mg、Cu组成的混合物26.4g,投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol/L的NaOH溶液300mL,金属离子完全沉淀.则形成沉淀的质量是
A. 32.8g B. 46.8g C. 53.6g D. 63.8g
难度: 中等查看答案及解析