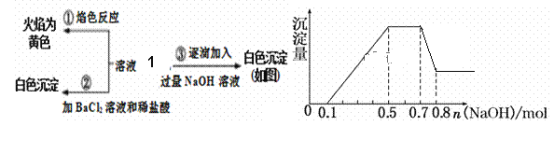
-
下列有关金属的说法正确的是( )
A. Na久置于空气中最终生成NaHCO3
B. Mg比Al活泼,更易与NaOH溶液反应生成H2
C. 水蒸气通过灼热的铁粉有红棕色固体生成
D. 多数合金比各成分金属熔点低,硬度大
难度: 简单查看答案及解析
-
下列说法不存在因果关系的是( )
A. 钠容易与空气中的水蒸气和氧气反应,所以钠保存在煤油中
B. 碳酸氢钠和碳酸钠的水溶液都呈碱性,所以它们被作为食用碱
C. 某化合物的焰色反应为黄色,说明该反应一定不含钾元素,因为钾元素的焰色反应为紫色
D. FeSO4可以防止油炸食物被氧化,因为FeSO4具有还原性
难度: 中等查看答案及解析
-
第十届亲水胶体国际会议于2010年6月20日到24日在上海举行,专家学者共同研讨亲水胶体在应用领域中关注的问题,下列关于胶体的说法正确的是( )
A. 直径介于1nm~100nm之间的微粒称为胶体
B. 胶体与其他分散系的本质区别是胶体有丁达尔效应
C. 胶体分散质粒子能透过半透膜和滤纸
D. Al(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
难度: 简单查看答案及解析
-
小民同学配置0.1mol·L-1的Na2CO3溶液480mL,你认为下列分析或操作正确的是 ( )
A. 用托盘天平称取5.30g固体
B. 容量瓶中原来存有少量蒸馏水,将导致溶液浓度偏低
C. 胶头滴管加水定容俯视刻度,将导致溶液浓度偏高
D. 加蒸馏水时不慎超过了刻度线,应立即用胶头滴管将超出部分的液体吸出
难度: 中等查看答案及解析
-
甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是( )
A. Al2(SO4)3 B. NaOH
C. BaCl2 D. FeSO4
难度: 中等查看答案及解析
-
闽东盛产牡蛎。明《弘治温州府志》指出:“蜃灰,以牡蝠壳烧灰为上”。将“蜃灰”溶于水可制成碱液,“蜃灰”的主要成分是( )
A. CaO B. CaCO3 C. SiO2 D. NaCl
难度: 简单查看答案及解析
-
分类是化学学习和研究的常用手段。下列分类依据和结论都正确的是()
A. H2O、 CH3COOH中均含有氧元素,都是氧化物
B. HClO、 NaHSO4均能电离出H+,都属于酸
C. NaCl、 NaClO3均属于氯化物,都能电离出Cl-
D. 金刚石、C60均是由碳元素组成的性质不同的单质,它们互为同素异形体
难度: 中等查看答案及解析
-
己知 2Na+O2
Na2O2,2Na2O2+2H2O=4NaOH+O2↑,2Na2O2+2CO2=2NaCO3+O2↑,下列灭火剂能用于扑灭金属钠着火的是()
A. 干冰灭火剂 B. 水 C. 黄沙 D. 泡沫灭火剂
难度: 中等查看答案及解析
-
下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是()
A. CuCl2 B. FeCl2 C. FeCl3 D. MgCl2
难度: 简单查看答案及解析
-
下列各组溶液中的离子能大量共存的是( )
A. NH4+、Ba2+、Cl-、OH- B. K+、NH4+、Cl-、SO42-
C. H+、SO32- Fe3+、Cl- D. Ba2+、Br-、CO32-、Na+
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是 ( )
A. 碳酸氢钠溶液与少量澄清石灰水反应:HCO3-+Ca2++OH-CaCO3↓+H2O
B. NaOH溶液与盐酸反应:H++OH-=H2O
C. CuSO4溶液和Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓
D. CO2通入氯化钙溶液:Ca2++CO2+H2O=CaCO3↓+2H+
难度: 中等查看答案及解析
-
对于下列反应的说法中正确的是( )
A. 2CuFeS2+O2===Cu2S+2FeS+SO2,CuFeS2是氧化剂,O2是还原剂
B. 3NO2+H2O===2HNO3+NO,氧化产物与还原产物的物质的量之比为2∶1
C. 足量的Fe在1.12L氯气中完全燃烧,转移电子数为0.1NA
D. Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O,说明还原性Cr3+> Fe2+
难度: 中等查看答案及解析
-
下列有关硅及其化合物的说法中不正确的是( )
A. 在粗硅的提取中发生反应2C+SiO2
2CO+Si,硅元素被还原
B. 太阳能电池可采用硅材料制作,其应用有利于环保、节能
C. 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D. 由Na2CO3+SiO2
CO2+Na2SiO3可知硅酸的酸性强于碳酸
难度: 中等查看答案及解析
-
某溶液含有K+、Fe3+、SO42-、OH-、I-中的几种。取样,滴加KSCN溶液后显血红色。为确定该溶液的组成,还需检验的离子是( )
A. K+ B. I- C. SO42- D. OH-
难度: 中等查看答案及解析
-
下列除去杂质(括号中的物质为杂质)的方法中,不正确的是( )
A. FeCl3溶液(FeCl2):通入适量Cl2
B. Fe2O3固体(Al2O3):加入烧碱溶液,过滤
C. CO2气体(HCl):通过NaOH溶液洗气后干燥
D. Na2CO3固体(NaHCO3):加热
难度: 中等查看答案及解析
-
下列各组物质,不能按
(“―→”表示反应一步完成)关系转化的是( )
选项
a
b
c
A
Al2O3
NaAlO2
Al(OH)3
B
AlCl3
Al(OH)3
NaAlO2
C
Al
Al(OH)3
Al2O3
D
MgCl2
Mg(OH)2
MgO
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是( )
A. 若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+
B. 若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含Cu2+和Fe3+
C. 若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+
D. 若滤出的固体中只有铜,则溶液中一定没有Fe3+,可能含有Cu2+
难度: 中等查看答案及解析