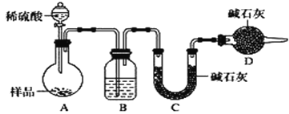
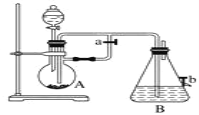
-
有Mg、Al混合粉末10.2g溶于50mL4mol/L的盐酸,若加入2mol/L的氢氧化钠溶液,使得沉淀达到最大量,则需加入氢氧化钠的体积为( )
A. 100mL B. 500mL C. 1000mL D. 1500mL
难度: 中等查看答案及解析
-
某同学欲大量配制含有下列四种不同阴、阳离子的溶液,其中能配制成功的是
A. K+、H+、Cl-、CO32- B. Mg2+、Al3+、Cl-、SO42-
C. Na+、H+、NO3-、Fe2+ D. Na+、Ba2+、HCO3-、OH-
难度: 中等查看答案及解析
-
下列现象不能用胶体知识解释的是( )
A. 向BaCl2溶液中加入Na2CO3溶液,会出现白色沉淀
B. 在江河入海处易形成三角洲
C. 冶金厂大量烟尘用高压电除去
D. 同一钢笔同时使用不同牌号的墨水易发生堵塞
难度: 简单查看答案及解析
-
下列离子方程式中,属于氧化还原反应的是( )
①Fe+Cu2+=Fe2++Cu ②Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
③Cl2+H2O=H++Cl-+HClO ④CO32-+2H+=CO2↑+H2O ⑤Ag++Cl-=AgCl↓
A. 只有③ B. ②③ C. ③⑤ D. ①③
难度: 简单查看答案及解析
-
关于氧化物Na2O2和Na2O,它们说法正确的是
A. 阴阳离子个数比均为1:2
B. 都是金属钠与氧气加热反应制得
C. 与水反应产物相同
D. Na2O2和Na2O长期置于空气中,最终产物不同
难度: 简单查看答案及解析
-
将一粒钠投入下列溶液中,能产生气体和沉淀的是
A. NaCl B. BaCl2 C. H2SO4 D. CuCl2
难度: 简单查看答案及解析
-
在含有FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的NaOH溶液,在空气中充分搅拌,反应后再加入过量的稀盐酸,溶液中离子数目减少的是( )
A. Na+ B. Fe3+ C. Fe2+ D. Al3+
难度: 简单查看答案及解析
-
下列说法不正确的是( )
①将BaSO4放入水中不能导电,所以BaSO4是非电解质
②氨气溶于水得到的氨水能导电,所以氨水是电解质
③固态氯化钠不导电,熔融态的氯化钠可以导电
④气态氯化氢不导电,液态氯化氢也不导电
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
A. ①④ B. ①④⑤ C. ①②⑤ D. ①②③④⑤
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 金属铜与硝酸银溶液反应:Cu+Ag+ =Cu2++Ag
B. Ba(OH)2溶液和H2SO4溶液反应:Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O
C. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
Fe(OH)3↓+3H+
D. 石灰乳与盐酸反应:Ca(OH)2+2H+ = Ca2++2H2O
难度: 中等查看答案及解析
-
铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:①TI3++2Ag=Tl++2Ag+,②Ag++Fe2+=Ag+Fe3+,③Fe+2Fe3+=3Fe2+。下列离子氧化性比较顺序正确的是
A. TI3+>Fe3+>Ag+
B. Fe3+>Ag+>TI3+
C. Tl+>Ag+>Fe2+
D. TI3+>Ag+>Fe2+
难度: 简单查看答案及解析
-
下列推理正确的是 ( )
A. 铝粉在氧气中燃烧生成Al2O3,故铁丝在氧气中燃烧生成Fe2O3
B. 铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜
C. 钠与O2、水等反应时钠均作还原剂,故金属单质参与化学反应时金属均作还原剂
D. 活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中
难度: 简单查看答案及解析
-
下列说法中不正确的是
A. Na2CO3和NaHCO3均能 与NaOH反应 B. Na2CO3比NaHCO3稳定
C. Na2CO3俗称纯碱,苏打 D. NaHCO3俗称小苏打
难度: 简单查看答案及解析
-
为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是 ( )

A. ② B. ③⑤ C. ③④ D. ①②③④⑤
难度: 简单查看答案及解析
-
已知某一反应2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,则关于该反应的说法错误的是( )
A. H2CrO4中铬元素显+6价
B. 该反应中的还原剂是H2O2,氧化产物是O2
C. 氧化性:H2CrO4>O2
D. 如反应转移了0.3mol电子,则产生的气体在标准状况下体积为1.68L
难度: 中等查看答案及解析
-
已知M2On2-离子可与R2-离子反应,R2-被氧化为R单质,M2On2-的还原产物中M为+3价;又已知100mL c(M2On2-)=0.2 mol·L-1的溶液可与100mL c(R2-)=0.6 mol·L-1的溶液恰好完全反应,则n值为
A. 4 B. 7 C. 6 D. 5
难度: 简单查看答案及解析