-
主族元素原子失去最外层电子形成阳离子,主族元素原子得到电子填充在最外层形成阴离子。下列各原子或离子的电子排布式错误的是( )
A. Ca2+ 1s22s22p63s23p6 B. O2- 1s22s23p4
C. Fe 1s22s22p63s23p63d64s2 D. Fe2+ 1s22s22p63s23p63d6
难度: 中等查看答案及解析
-
下列原子中未成对电子数最多的是( )
A. C B. O C. N D. Cl
难度: 中等查看答案及解析
-
在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是
A. sp,范德华力 B. sp2,范德华力
C. sp2,氢键 D. sp3,氢键
难度: 中等查看答案及解析
-
下列事实不能用键能的大小来解释的是( )
A. N元素的电负性较大,但N2的化学性质很稳定
B. 惰性气体一般难发生反应
C. HF、HCl、HBr、HI的稳定性逐渐减弱
D. F2比O2更容易与H2反应
难度: 中等查看答案及解析
-
下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是
A. sp杂化轨道的夹角最大 B. sp2杂化轨道的夹角最大
C. sp3杂化轨道的夹角最大 D. sp3、sp2、sp杂化轨道的夹角相等
难度: 中等查看答案及解析
-
前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有
A. 3种 B. 4种 C. 5种 D. 6种
难度: 简单查看答案及解析
-
现有如下各说法:
①在水中氢、氧原子间均以化学键相结合。
②金属和非金属化合形成离子键。
③离子键是阳离子、阴离子的相互吸引。
④根据电离方程式HClH++Cl-,判断HCl分子里存在离子键。
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程。
上述各种说法正确的是( )
A. ①②⑤正确 B. 都不正确 C. ④正确,其他不正确 D. 仅①不正确
难度: 简单查看答案及解析
-
氰气的化学式为(CN)2,结构式为N≡C—C≡N,性质与卤素相似,下列叙述正确的是( )
A. 分子中既有极性键,又有非极性键
B. 分子中N≡C键的键长大于C—C键的键长
C. 分子中含有2个σ键和4个π键
D. 不和氢氧化钠溶液发生反应
难度: 简单查看答案及解析
-
最活泼的金属元素、最活泼的非金属元素、常温下呈液态的金属(价电子排布为5d106s2)元素分别位于下面元素周期表中的( )

A. s区、p区、ds区 B. s区、p区、d区
C. f区、p区、ds区 D. s区、f区、ds区
难度: 简单查看答案及解析
-
下列同周期元素中,原子半径最小的是
A. Mg B. Al C. Si D. S
难度: 简单查看答案及解析
-
电子数相等的微粒叫等电子体,下列各组微粒属于等电子体的是
A. NO和NO2 B. C2H4和N2
C. NH4+和OH﹣ D. NO和CO2
难度: 简单查看答案及解析
-
下列物质中含有非极性键的共价化合物是( )
A. HCl B. Na2O2 C. C2H2 D. CH4
难度: 简单查看答案及解析
-
具有下列电子层结构的原子,其对应的元素一定属于同一周期的是( )
A. 两种元素原子的电子层上全部都是s电子
B. 3p能级上只有1个空轨道的原子和3p能级上只有1个未成对电子的原子
C. 最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子
D. 原子核外的M层上的s、p能级上都填满了电子而d轨道未排电子的两种原子
难度: 中等查看答案及解析
-
A原子的结构示意图为
。则x、y及该原子3p能级上的电子数分别为( )
A. 18、6、4 B. 20、8、6
C. 18、8、6 D. 15~20、3~8、1~6
难度: 中等查看答案及解析
-
电子在一个原子的下列能级中排布时,最后一个排布的是( )
A. ns B. np C. (n-1)d D. (n-2)f
难度: 简单查看答案及解析
-
在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是:
A.Li,F B.Na,F C.Na,C1 D.Mg,O
难度: 中等查看答案及解析
-
从键长的角度来判断下列共价键中最稳定的是( )
A. H—F B. H—N C. H—C D. H—S
难度: 中等查看答案及解析
-
基态硅原子的最外能层的各能级中,电子排布的方式正确的是( )
A.
B.
C.
D.

难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. [Ne]3s2表示的是Mg原子
B. 3p2表示第三能层有2个电子
C. 同一原子中,1s、2s、3s电子的能量逐渐减小
D. 2p、3p、4p能级容纳的最多电子数依次增多
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. 第ⅠA族元素的电负性从上到下逐渐减小,而第ⅦA族元素的电负性从上到下逐渐增大
B. 电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度
C. 元素的电负性越大,表示其原子在化合物中吸引电子能力越强
D. NaH的存在能支持可将氢元素放在第ⅦA族的观点
难度: 简单查看答案及解析
-
在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的( )
A. 2Na2O2+2H2O=4NaOH+O2↑
B. Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
C. Cl2+H2O=HClO+HCl
D. NH4Cl+NaOH
NaCl+NH3↑+H2O
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. 含有非极性键的分子一定是非极性分子
B. 非极性分子中一定含有非极性键
C. 由极性键形成的双原子分子一定是极性分子
D. 两个原子之间共用两对电子,形成的化学键一定有极性
难度: 简单查看答案及解析
-
向下列配合物的水溶液中加入AgNO3溶液不能生成AgCl沉淀的是
A. [Co(NH3)4Cl2]Cl B. [Co(NH3)3Cl3] C. [Co(NH3)6]Cl3 D. [Co(NH3)5Cl]Cl2
难度: 中等查看答案及解析
-
NH3、H2S等是极性分子,CO2,BF3,CCl4等是含极性键的非极性分子。根据上述实例可推出ABn型分子是非极性分子的经验规律是( )
A. 分子中不能含有氢原子
B. 在ABn分子中A的相对原子质量应小于B的相对原子质量
C. 在ABn分子中A原子没有孤电子对
D. 分子中每个共价键的键长应相等
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 键能越大,表示该分子越容易受热分解
B. 共价键都具有方向性
C. 在分子中,两个成键的原子间的距离叫键长
D. H—Cl的键能为431.8 kJ·mol-1,H—Br的键能为366 kJ·mol-1,这可以说明HCl比HBr分子稳定
难度: 简单查看答案及解析
-
下列原子半径最小的是( )
A. 1s22s22p3 B. 1s22s22p33s23p3
C. 1s22s22p5 D. 1s22s22p33s23p2
难度: 简单查看答案及解析
-
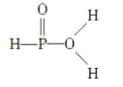
已知磷酸分子
 中三个氢原子都可以与重水(D2O)中的D原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( )
中三个氢原子都可以与重水(D2O)中的D原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( )A.
B.
C.
 D.
D. 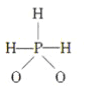
难度: 中等查看答案及解析
-
乙烯分子中含有4个C—H键和1个C=C键,6个原子在同一平面上。下列关于乙烯分子的成键情况分析正确的是 ( )
①每个C原子的2s轨道与2p轨道杂化,形成两个sp杂化轨道 ②每个C原子的2s轨道与2个2p轨道杂化,形成3个sp2杂化轨道 ③每个C原子的2s轨道与3个2p轨道杂化,形成4个sp3杂化轨道 ④每个C原子的3个价电子占据3个杂化轨道,1个价电子占据1个2p轨道
A. ①③ B. ②④ C. ①④ D. ②③
难度: 中等查看答案及解析
-
1919年,Langmuir提出等电子体的概念,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体。等电子体的结构相似,物理性质相近。据上述原理,下列各对粒子中,空间结构相似的是( )
A. SO2和O3 B. CO2和NO2
C. CS2和NO2 D. PCl3和BF3
难度: 中等查看答案及解析