-
下列物质分类正确的是
A. SO2、SiO2、CO均为酸性氧化物
B. 稀豆浆、硅酸、氯化铁溶液均为胶体
C. 烧碱、冰醋酸、四氯化碳均为电解质
D. 福尔马林、水玻璃、氨水均为混合物
难度: 简单查看答案及解析
-
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
操作
现象
结论
A
滴加BaCl2溶液
生成白色沉淀
原溶液中有SO42—
B
滴加氯水和CCl4,振荡、静置
下层溶液显紫色
原溶液中有I-
C
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+、无K+
D
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
难度: 中等查看答案及解析
-
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
选项
陈述Ⅰ
陈述Ⅱ
A
SO2有漂白性
SO2可使溴水褪色
B
SiO2有导电性
SiO2可用于制备光导纤维
C
浓硫酸有强氧化性
浓硫酸可用于干燥H2和CO
D
Fe3+有氧化性
FeCl3溶液可用于回收废旧电路板中的铜
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与科学、技术、社会、环境密切相关。下列有关说法中正确的是( )
A. 小苏打可用于生产玻璃,也可用来除去物品表面的油污
B. 过氧化钠可用于食品、羽毛和织物等的漂白
C. 医用酒精、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的
D. 汽车尾气、工业排放、建筑扬尘、垃圾焚烧等都是造成雾霾天气的主要原因
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.SiO2既能溶于NaOH溶液又能溶于氢氟酸,说明SiO2是两性氧化物
B.将Cu片置于浓H2SO4中,无明显现象,说明Cu在冷的浓硫酸中被钝化
C.“雷雨发庄稼”的实质是自然固氮
D.自来水厂可用明矾对水进行杀菌消毒
难度: 中等查看答案及解析
-
下列各组离子在常温下一定能大量共存的是( )
A. NaHS溶液中:SO42-、K+、Cl-、Cu2+
B. 在c(H+)/c(OH-)=1012的溶液中:NH4+、NO3-、K+、Cl-
C. 加入铝粉能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl-
D. 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 常温下,pH=2的H2SO4溶液中含有的H+离子数目为0.01NA
B. 当H2O与Na2O2反应生成1 molO2时,转移的电子数目为4NA
C. 标准状况下,2.24 L CO和CO2混合气体中含有的碳原子数为0.1NA
D. 1 L 0.1 mol·L-1 FeCl3溶液中含有的Fe3+离子数目为0.1NA
难度: 中等查看答案及解析
-
用98%的浓H2SO4(密度为1.84g/cm3)配制1 mol/L的稀H2SO4 100 mL,配制过程中需用仪器的先后顺序是( )
①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒
A. ①③⑤⑥⑦ B. ②③⑦⑤⑥
C. ②⑤⑦⑥① D. ④③⑦⑤⑥
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A. SO2、NO2都能与水反应,其反应原理不同
B. N2与O2在放电条件下直接化合生成NO2
C. 常温下铁与浓硫酸、浓硝酸均不反应,可用铁槽车密封运送浓硫酸、浓硝酸
D. CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
难度: 简单查看答案及解析
-
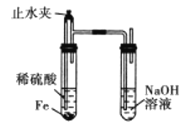
下列实验操作能达到实验目的的是( )
A. 氢氧化亚铁的生成
 B. 比较碳酸钠与碳酸氢钠的热稳定性
B. 比较碳酸钠与碳酸氢钠的热稳定性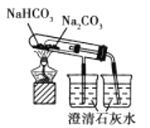 C. 实验室制取少氨气
C. 实验室制取少氨气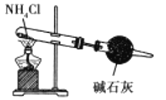 D. 检查装置气密性
D. 检查装置气密性
难度: 中等查看答案及解析
-
为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是( )
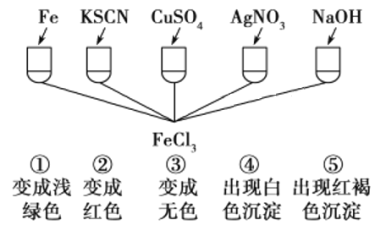
A. 只有④ B. 只有③
C. ③和④均错误 D. 全部错误
难度: 简单查看答案及解析
-
下列关于元素及其化合物的说法不正确的是( )
A. 过氧化钠放置在空气中,最终转变为白色粉末Na2CO3
B. Ca(ClO)2溶液通入CO2,溶液变浑浊;再加入品红溶液,红色褪去
C. 打磨过的铝箔和未打磨的铝箔分别在空气中灼烧,两种铝箔均熔化但不滴落,说明氧化铝熔点比铝高
D. 在一定条件下,金属Na、Mg、Fe与水反应都生成H2和对应的碱
难度: 中等查看答案及解析
-
已知酸性条件下有如下反应:2Cu+===Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
加入
试剂
稀硫酸
浓硫酸、
加热
稀硝酸
浓硝酸
实验
现象
红色固体和蓝色溶液
无色气体和蓝色溶液
无色气体和蓝色溶液
红棕色气体和蓝色溶液
由此推出本次氢气还原氧化铜实验的产物是( )
A. Cu B. Cu2O
C. 一定有Cu,可能有Cu2O D. 一定有Cu2O,可能有Cu
难度: 中等查看答案及解析
-
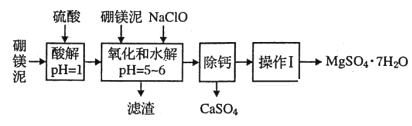
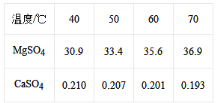
世界上60%的镁是从海水中提取的,其主要步骤如下:
①把贝壳制成生石灰;②在海水中加入生石灰,过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤;④在氯化氢热气流中加热晶体;⑤电解上述所得盐(熔融条件下)。下列说法正确的是( )
A.向洗涤液中滴加氯化钙溶液可检验沉淀是否洗涤干净
B.上述变化过程中包括了分解、化合、复分解、置换等四种反应类型
C.步骤④在氯化氢热气流中加热晶体的目的是为了防止氯化镁水解
D.步骤⑤也可以采用电解该盐水溶液的方法
难度: 中等查看答案及解析
-
磁性氧化铁与过量稀硝酸反应的化学方程式为:Fe3O4+HNO3(稀)―→Fe(NO3)3+NO↑+H2O(未配平)。下列有关说法正确的是( )
A. 如果硝酸的量不足,则应该有Fe(NO3)2生成
B. 上述反应配平后HNO3的化学计量数为10
C. 23.2 g磁性氧化铁完全溶解于稀硝酸中,转移0.1 mol电子
D. 若有0.1 mol HNO3被还原,则生成2.24 L NO气体
难度: 中等查看答案及解析
-
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是:
A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
难度: 简单查看答案及解析
-
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
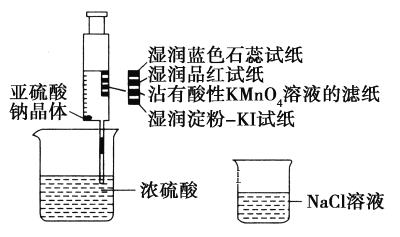
A. 蓝色石蕊试纸先变红后褪色
B. 品红试纸、沾有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性
C. 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2
D. NaCl溶液可用于除去实验中多余的SO2
难度: 困难查看答案及解析
-
下列由相关实验现象所推出的结论正确的是( )
A. 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
B. 向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42-
C. Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D. Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
难度: 中等查看答案及解析
-
下列实验设计能够达到目的的是( )
编号
实验目的
实验设计
A
除去CO2中少量的SO2
将混合气体通过饱和Na2CO3溶液
B
除去Cu粉中混有的CuO
向混合物中滴加适量稀硝酸
C
证明钠的金属活动性比铝强
向AlCl3溶液中投入钠粒
D
证明H2CO3酸性比H2SiO3强
将CO2通入Na2SiO3溶液中
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1 mol·L-1乙溶液中c(H+)>0.1 mol·L-1;③向丙溶液中滴入AgNO3溶液有不溶于稀硝酸的白色沉淀生成。下列结论错误的是( )
A. 丁溶液含有Mg2+ B. 乙溶液含有SO42-
C. 丙溶液含有Cl- D. 甲溶液含有Ba2+
难度: 中等查看答案及解析
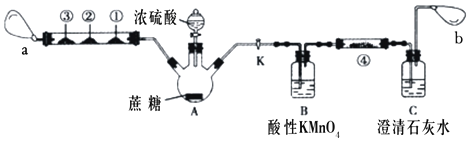
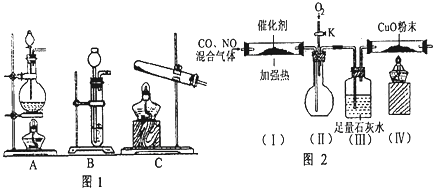
 CO+H2O,实验室有如图所示的装置,制取CO气体可选用的装置为_______________________(填序号),实验室利用该装置还可以制取的气体有______________(写一种气体的分子式)。
CO+H2O,实验室有如图所示的装置,制取CO气体可选用的装置为_______________________(填序号),实验室利用该装置还可以制取的气体有______________(写一种气体的分子式)。