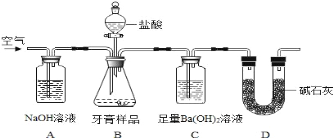
-
下列实验操作完全正确的是
编号
实验
操作
A
钠与水反应
用镊子从煤油中取出金属钠,切下绿豆大小的钠,
小心放入装满水的烧杯中
B
配制一定浓度的氯化钾溶液1000mL
准确称取氯化钾固体,放入到1000ml的容量瓶中,
加水溶解,振荡摇匀,定容
C
检查容量瓶是否漏水的方法是
往容量瓶中加水,塞好瓶塞,将容量瓶倒过来,
若不漏水,则容量瓶不漏水
D
取出分液漏斗中所需的上层液体
下层液体从分液漏斗下端管口流出,关闭活塞,
换一个接收容器,上层液体从分液漏斗上端管口倒出
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
根据表中信息判断,下列说法不正确的是
序号
反应物
产物
①
KMnO4、H2O2、H2SO4
K2SO4、MnSO4
②
Cl2、FeBr2
FeCl3、FeBr3
③
MnO4-、Cl-
Cl2、Mn2+
A. 第①组反应的其余产物为H2O和 O2
B. 第②组反应从产物可以得出还原性:Fe2+>Br-
C. 第③组反应中生成1 mol Cl2,转移电子数为2NA
D. 氧化性由强到弱的顺序为MnO4->Cl2>Fe3+>Br2
难度: 困难查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2—+4NH4++2H2O
B. 浓烧碱溶液中加入铝片:Al+2OH-=AlO2—+H2↑
C. 用浓NaOH溶液溶解Al2O3:2OH-+Al2O3=2AlO2—+H2O
D. 往碳酸镁中滴加稀盐酸:CO32—+2H+=CO2↑+H2O
难度: 简单查看答案及解析
-
判断下列概念的依据正确的是
A. 纯净物与混合物:是否仅含有一种元素
B. 溶液与胶体:本质不同的原因是能否发生丁达尔现象
C. 强电解质与弱电解质:溶液的导电能力大小
D. 氧化还原反应的本质:有电子的得失或偏移
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 金属钠应该密封保存在煤油中
B. 焰色反应时,铂丝需用稀硫酸洗净,并在火焰上灼烧至无色
C. 蒸馏时加入沸石的目的是为了防止暴沸
D. 使用容量瓶配制溶液定容时仰视刻度线会使得所配溶液浓度偏小
难度: 简单查看答案及解析
-
下列说法正确的是
A. Fe(OH)3胶体均一、透明,能产生丁达尔效应
B. 硫酸溶液的导电性定比醋酸溶液的导电性强
C. 用萃取分液的方法除去酒精中的水
D. CO2溶于水后得到的溶液可以导电,所以CO2属于电解质
难度: 困难查看答案及解析
-
在给定的四种溶液中加入以下各种离子,能在原溶液中大量共存的是
A. 常温下强酸性 的溶液: K+、HCO3-、Br−、Ba2+
B. 滴加酚酞溶液显红色的溶液:Fe3+、NH4+、Cl−、NO3-
C. 所含溶质为FeCl3的溶液:K+、SO42-、NO3-、H+
D. 强碱性溶液:Cu2+、Na+、Mg2+、NO3-
难度: 中等查看答案及解析
-
下列说法在一定 条件下可以实现的有
①酸性氧化物与碱反应生成酸式盐 ②没有水生成,也没有沉淀和气体生成的复分解反应
③有单质参加的非氧化还原反应 ④两种氧化物反应的产物有气体
A. 1 个 B. 2 个 C. 3 个 D. 4个
难度: 中等查看答案及解析
-
把一定量的Ba(OH)2溶液滴入明矾[KAl(SO4)2·12H2O]溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是
A. Al3+ B. Al(OH)3
C. AlO2- D. Al3+和Al(OH)3
难度: 简单查看答案及解析
-
在t ℃时将a g NH3完全溶于水得到V mL溶液,该溶液的密度为ρg·cm-3,质量分数为w。下列说法正确的是
A. 溶质的质量分数w=a/(Vρ-a)×100%
B. 溶质的物质的量浓度c= a/17V mol·L-1
C. 溶液密度ρ可表示为 17c/w g·cm-3
D. 上述溶液中再加入V mL水,所得溶液溶质的质量分数小于0.5w
难度: 困难查看答案及解析
-
将固体X投入过量Y中,能生成白色沉淀并放出一种无色气体,该气体能燃烧,且不易溶于水,则X和Y可能依次是
A. 钠和氯化铝溶液 B. 铝和烧碱溶液
C. 过氧化钠和氯化亚铁溶液 D. 锌和稀硫酸
难度: 中等查看答案及解析
-
把足量铁粉投入到硫酸和硫酸铜的混合溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO42-的物质的量浓度之比是
A. 1:4 B. 2:7 C. 1:2 D. 3:8
难度: 中等查看答案及解析
-
下列图像均为实验过程中产生沉淀的物质的量(Y)与加入试剂的量(X)之间的关系图,则其中正确的是
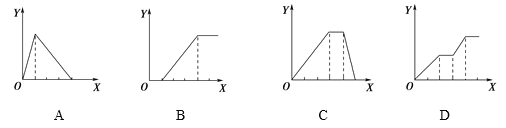
A. 向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B. 向NaAlO2溶液中逐滴滴加稀盐酸至过量且边滴边振荡
C. 向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量
D. 向等物质的量浓度的NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量
难度: 困难查看答案及解析
-
某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和 Na+。某同学为确定其组分,设计并完成了如下实验:
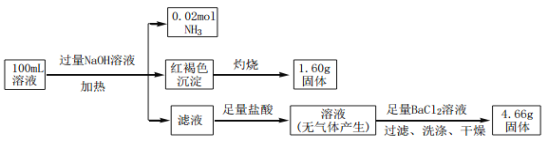
由此可推测原溶液中
A. SO42-、NH4+和Na+一定存在,CO32-一定不存在
B. SO42-、NH4+一定存在,Na+和CO32-一定不存在
C. c(Fe3+)=0.1 mol•L-1
D. c(Cl-)≥0.4mol•L-1
难度: 中等查看答案及解析
-
在托盘天平两端的烧杯中加入同浓度同体积的足量盐酸,当向两个烧杯中分别加入0.1mol两种金属充分反应后,而在某一端要再放一个0.2g砝码,天平才能平衡,则这两种金属是
A. Mg和Al B. Al和Fe C. Fe和Cu D. Na和Mg
难度: 困难查看答案及解析
-
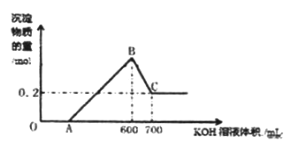
浓度相同的NaOH溶液各100 mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示。下列判断正确的是(气体体积取标准状况计算)
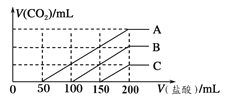
A. 通入CO2后,A烧杯中的溶质成分是Na2CO3
B. B烧杯中通入的CO2体积为448 mL
C. 原NaOH溶液的浓度为0.2 mol/L
D. 通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶2
难度: 困难查看答案及解析