-
设NA表示阿伏加德罗常数的值,下列叙述中不正确的是
A. 常温常压下,11.2LCH4气体中含有的CH4分子数小于0.5NA
B. 标准状况下,0.56L丙烷中含有共价键的数目为0.25NA
C. 1 mol碳烯(∶CH2)所含的电子数目为8NA
D. 标准状况下,22.4LNO2与水充分反应转移电子数目为2NA
难度: 中等查看答案及解析
-
已知A、B、C、D为短周期内原子序数依次增大的元素,X、Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、乙为其中两种元素对应的单质.若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是

A. 沸点N>M
B. A、C、D的常见氧化物相互之间一定能反应
C. 简单离子半径:D2->B2->C+>A+
D. C与其他元素均能形成离子化合物
难度: 中等查看答案及解析
-
有机物的结构可用“键线式”表示,如CH3—CH=CH—CH3可简写为
,有机物X的键线式为
。下列关于有机物X的说法中正确的是
A. X的含氧官能团是羧基和醚键
B. X的分子式为C7H7O3
C. X因能与酸性KMnO4溶液发生取代反应而褪色
D. 有机物Y是X的同分异构体,能与碳酸氢钠溶液反应且含苯环,则Y的结构有3种
难度: 中等查看答案及解析
-
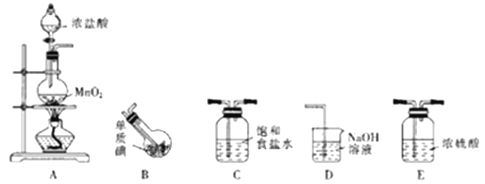
用下列实验装置进行相应实验,能达到实验目的的是

A. 用图1所示装置可收集NO气体
B. 用图2所示装置可吸收多余氨气且能防止倒吸
C. 用图3所示装置可实现反应:Cu +2H2O
Cu(OH)2 +H2↑
D. 用图4所示装置可分离乙醇(沸点:78.4℃)与二甲醚(沸点:24.9℃)的混合物
难度: 中等查看答案及解析
-
我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应H2S+O2==H2O2+S。已知甲池中发生的反应为
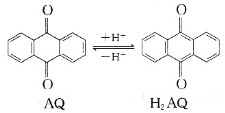
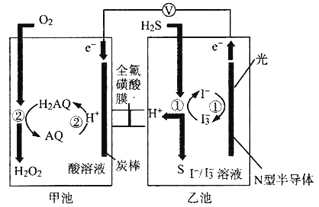
下列说法不正确的是
A. 该装置中存在光能向电能的转化
B. H+从乙池移向甲池
C. 乙池溶液中发生的反应为H2S+I3-===3I-+S+2H+
D. 甲池中炭棒上发生的电极反应为AQ+2H+-2e-===H2AQ
难度: 困难查看答案及解析
-
25℃时,用0.1mol•L-1NaOH溶液滴定20mL 0.1mol•L-1 H2SO3溶液的滴定曲线如图所示.下列说法正确的是

A. a点:c(H2SO3)+ c(HSO3-)+c(SO32-)=0.1 mol•L-1
B. b点:c(Na+)>c(HSO3-.)> c(H2SO3)> c(SO32-)
C. 溶液导电性b>c
D. a、b、c、d中,d点水的电离度最大
难度: 困难查看答案及解析
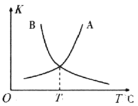
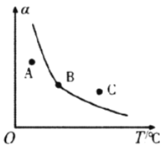

 (R1、R2、R3、R4可能是氢、烃基或其他基团)
(R1、R2、R3、R4可能是氢、烃基或其他基团)