-
下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是
A. Na和O2 B. NaOH和CO2 C. Na2O2和CO2 D. 木炭(C)和O2
难度: 简单查看答案及解析
-
配制100 mL 1 mol/L NaCl溶液,下列操作中错误的是
A. 在托盘天平上放两片大小一样的纸,然后将氯化钠放在纸片上称量
B. 把称得的氯化钠放入盛有适量蒸馏水的烧杯中,溶解、冷却,再把溶液移入容量瓶中
C. 沿玻璃棒往容量瓶中加入蒸馏水,直至溶液凹液面恰好与刻度线相切
D. 用蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液也移入容量瓶中
难度: 简单查看答案及解析
-
下列反应可用离子方程式H++OH−=H2O表示的是
A. NaHSO4溶液与NaOH溶液混合 B. H2SO4溶液与Ba(OH)2溶液混合
C. NaHCO3溶液与KOH溶液混合 D. NH4Cl溶液与NaOH溶液混合
难度: 简单查看答案及解析
-
“钴酞菁”分子(直径约为1.34x10-9m)结构和性质与人体内的血红素及植物内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是
A. “钴酞菁”分子在水中所形成的分散系属悬浊液
B. “钴酞菁”分子既能透过滤纸,也能透过半透膜
C. 在分散系中,“钴酞菁”分子直径比Na+的直径小
D. “钴酞菁”分子在水中形成的分散系能产生丁达尔现象
难度: 简单查看答案及解析
-
正确的实验操作是实验成功的基本保证。下列实验操作正确的是
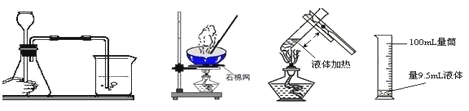
A. 检查装置气密性 B. 蒸发 C. 加热液体 D. 量取液体体积
难度: 简单查看答案及解析
-
下列说法正确的是
A. CO2和SO2的水溶液能够导电,所以CO2和SO2属于电解质
B. BaSO4在水中的溶解度很小不导电,属于非电解质
C. 非电解质溶液的导电能力也可以比电解质溶液的导电能力强
D. 非电解质的溶解度小于电解质的溶解度
难度: 简单查看答案及解析
-
下列各组物质都是化合物的是
A. 氨气、溴蒸气、氯气 B. 冰、干冰、冰醋酸
C. 汽油、甘油、煤焦油 D. 王水、重水、石灰水
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,22.4LSO3含有NA个分子
B. 0.1molNa2O2与CO2反应转移的电子数为0.2NA
C. 6.4gCH4含有的C-H键为1.6NA
D. 0.1mol/L的乙酸溶液中含有的H+数目小于0.1NA
难度: 中等查看答案及解析
-
下列关于摩尔质量的说法正确的是
A. 水的摩尔质量是18g
B. 任何物质的摩尔质量都等于它的相对分子质量或相对原子质量
C. 2mol水的摩尔质量是1mol水摩尔质量的2倍
D. 水的摩尔质量是氢气摩尔质量的9倍
难度: 简单查看答案及解析
-
V mL硫酸铝溶液中含Al3+a g,取V/4 mL溶液稀释到4V mL,稀释后溶液中SO42-的物质的量浓度是
A. 125a/9V mol/L B. 125a/18V mol/L
C. 125a/36V mol/L D. 125a/54V mol/L
难度: 中等查看答案及解析
-
关于粗盐提纯的下列说法中正确的是
A. 溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解
B. 当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干
C. 将制得的食盐晶体转移到新制过滤器中用大量水进行洗涤
D. 除去粗盐中的Ca2+、Mg2+、SO42-,可依次加入足量的Na2CO3溶液、NaOH溶液、BaCl2溶液、稀盐酸
难度: 中等查看答案及解析
-
如图是NaCl、NH4Cl和NaHCO3的溶解度曲线,下列说法不正确的是( )
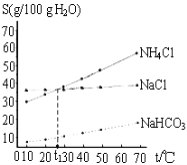
A. t1℃时,饱和NaCl 和NH4Cl 溶液的质量分数相同
B. 相同温度下,NaHCO3在水中的溶解度比NaCl和NH4Cl小很多
C. NH4Cl溶解度随温度变化较大
D. t1℃,饱和NaCl和NH4Cl 溶液的物质的量浓度相同
难度: 中等查看答案及解析
-
最初化学家对氧化锆的分子式有争议,经测定,锆(Zr)的相对原子质量约为91,其氯化物蒸气的密度是同温同压下H2密度116~117倍,试判断与氯化物价态相同的氧化锆的分子式
A. ZrO B. Zr2O C. Zr2O3 D. ZrO2
难度: 中等查看答案及解析
-
氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C
2AlN+3CO。有关该反应下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. AlN中氮的化合价为+3
C. 上述反应中,每生成1 molAlN需转移3 mol电子
D. AlN的摩尔质量为41 g
难度: 简单查看答案及解析
-
下列操作使所配溶液的浓度偏小的是
A. 定容摇匀后发现溶液凹面低于刻度线,加水至刻度线
B. 用量筒量取浓盐酸时,仰视刻度线
C. 定容时,俯视刻度线
D. 容量瓶在使用前未干燥,里面有少量蒸馏水
难度: 中等查看答案及解析
-
下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确
①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al
Al2O3+2Fe;1∶2
③SiO2+3C
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O===2HNO3+NO;2∶1
A. ①③ B. ②③ C. ②④ D. ①④
难度: 简单查看答案及解析
-
下列反应中,水既不是氧化剂、也不是还原剂的氧化还原反应是
A. Mg+2H2O=Mg(OH)2+H2↑ B. 2F2+2H2O=4HF+O2
C. Na2O+H20=2NaOH D. 2Na2O2+2H2O=4NaOH+O2↑
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是
A. 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B. 氢氧化钠溶液与醋酸反应:OH-+H+=H2O
C. 铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
D. 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu
难度: 中等查看答案及解析
-
下列做法能达到目的的是
A. 将25.0 g胆矾溶于水后配成100 mL溶液所得溶液浓度为1 mol/L
B. 将58.5 g NaCl溶于1 L水中,可得1 mol/L的NaCl溶液
C. 可使用250 mL容量瓶分两次完成490 mL某浓度的BaCl2溶液的配制
D. 将碘的四氯化碳溶液通过分液方法分离二者
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 实验室应将钠保存在煤油中
B. 某试样焰色反应呈黄色,则试样中可能含有K+
C. 可用酒精代替CCl4萃取碘水中的碘单质
D. 金属镁失火不可用二氧化碳来灭火
难度: 简单查看答案及解析
-
关于钠的叙述中,正确的是
A. 钠是银白色金属,熔点低,硬度大
B. 加热时,金属钠剧烈燃烧,产生黄色火焰
C. 钠与氧气反应时,产物是由O2的用量决定的
D. 金属钠着火可以用泡沫灭火器或用干燥的沙土灭火
难度: 简单查看答案及解析
-
某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子(不考虑水电离出的H+和OH-),物质的量浓度之比为c(Na+)∶c(Mg2+)∶c(Cl-)=3∶5∶5。若Na+的物质的量浓度为3 mol·L-1,则SO42-的物质的量浓度为
A. 2 mol·L-1 B. 3 mol·L-1 C. 4 mol·L-1 D. 8 mol·L-1
难度: 中等查看答案及解析
-
有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的Na+的物质的量浓度(单位:mol·L-1)为
A. (y-2x)/a B. (2y-4x)/a C. (2y-2x)/a D. (y-x)/a
难度: 困难查看答案及解析
-
在下列条件下,一定能大量共存的离子组是( )
A. 无色透明的水溶液中:K+、Mg2+、I﹣、MnO4﹣
B. 在强碱溶液中:Na+、K+、CO32﹣、NO3﹣
C. 有SO42﹣存在的溶液中:Na+、Mg2+、Ca2+、H+
D. 在强酸溶液中:NH4+、HCO3-、SO42﹣、Cl﹣
难度: 中等查看答案及解析
-
下列离子检验的方法正确的是
A. 某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+
B. 某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有SO42-
C. 某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl-
D. 某溶液中加稀硫酸生成无色无味气体,说明原溶液中有CO32-
难度: 中等查看答案及解析