-
卫生部发生公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是
A. CaO2具有氧化性,对面粉可能具有漂白作用
B. CaO2中阴阳离子的个数比为1: 1
C. CaO2和水反应时,每产生1 mol O2转移电子4 mol
D. CaO2和CO2反应的化学方程式为:2CaO2+2CO2===2CaCO3+O2
难度: 中等查看答案及解析
-
化学与人类生产、生活密切相关,下列有关说法不正确的是
A. 氮化硅、氧化铝陶瓷和光导纤维都是无机非金属材料
B. 为测定熔融氢氧化钠的导电性,常将氢氧化钠固体放在石英坩埚中加热熔化
C. 绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物
D. 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施
难度: 中等查看答案及解析
-
下列关于胶体的说法正确的是
A. 将可见光通过胶体出现“光路”是因为发生了光的折射
B. 多数胶粒具有选择性吸附阳离子或阴离子的性质,故在电场作用下会产生电泳现象
C. 稀豆浆、硅酸、氯化铁溶液均为胶体
D. 向沸水中逐滴加入少量饱和FeCl3溶液,继续加热搅拌可制得Fe(OH)3胶体
难度: 中等查看答案及解析
-
下列叙述正确的是
A. CO2、H2S、NH3都是非电解质
B. 酸性氧化物不一定都是非金属氧化物
C. 强酸、强碱、盐都是离子化合物
D. FeBr3、FeCl2、CuS都不能直接用化合反应制备
难度: 中等查看答案及解析
-
下列分类或归类正确的是
①液氯、氨水、干冰、碘化银均为纯净物 ②CaCl2、NaOH、HCl、IBr均为化合物
③明矾、水银、烧碱、硫酸均为电解质 ④碘酒、淀粉溶液、水雾、纳米材料均为胶体
⑤C60、C70、金刚石、石墨均为碳的同素异形体
A. ②⑤ B. ②③ C. ①③⑤ D. ②③④⑤
难度: 中等查看答案及解析
-
下列应用不涉及氧化还原反应的是
A. 铝热法冶炼难熔金属
B. FeCl3溶液可用于铜质印刷线路板制作
C. Na2O2用作呼吸面具的供氧剂
D. 实验室用氯化铵和消石灰制备NH3
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数,下列叙述正确的是
A. 标准状况下,11.2L的O2和NO的混合物含有的分子数约为0.5×6.02×1023
B. 1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA
C. 常温常压下,42g 乙烯和丁烯混合气体中,极性键数为6NA
D. 1 mol Fe与足量的稀HNO3反应,转移2NA个电子
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z原子序数依次增大。W原子的最外层电子数是X原子最外层电子数的两倍,质子数比X原子少5个,Y原子的最外层电子数是次外层电子数的一半,Z和W在同一主族。下列说法正确的是
A. 原子半径:W<X<Y<Z
B. X、Y、Z单质的熔点:Z<Y<X
C. 简单气态氢化物的热稳定性:Y<Z<W
D. Z元素的最高价氧化物对应水化物的分子中存在非极性共价键
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A. Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B. 等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓
C. 将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O =HClO+ HSO3-
D. 将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 中性溶液:Fe3+、K+、Cl-、SO42-
B. 1.0 mol·L-1的FeCl3溶液:H+、S2-、Cl-、SO42-
C. pH=12的溶液:K+、Na+、CH3COO-、Br-
D. 与铝反应产生氢气的溶液:Na+、K+、CO32-、NO3-
难度: 中等查看答案及解析
-
下列除杂方案不正确的
选项
被提纯的物质
[括号内的物质是杂质]
除杂试剂
除杂方法
A
CO2(g) [HCl(g)]
饱和碳酸氢钠溶液、 浓H2SO4
洗气
B
NH4Cl(aq) [Fe3+(aq)]
NaOH溶液
过滤
C
Cl2(g) [HCl(g)]
饱和食盐水、浓H2SO4
洗气
D
Na2CO3(s) [NaHCO3(s)]
—
加热
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
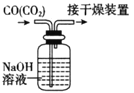
下列有关实验的选项正确的是
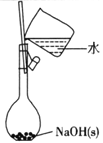
A.配制0. l0mol/L NaOH溶液
B.除去CO中的CO2
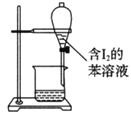
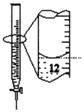
C.苯萃取碘水中的I2,分出水层后的操作
D.记录滴定终点读数为12.20 mL
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
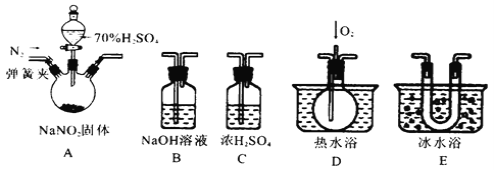
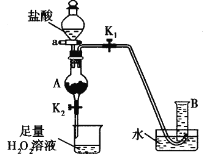
某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如图所示:
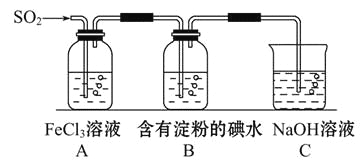
下列说法不合理的是( )
A. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B. 装置C的作用是吸收SO2尾气,防止污染空气
C. 为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2,产生白色沉淀
D. 为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
难度: 困难查看答案及解析
-
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
A. 至少存在5种离子
B. Clˉ一定存在,且c(Clˉ)≥0.4mol/L
C. SO42ˉ、NH4+一定存在,CO32-可能存在
D. CO32ˉ、Al3+一定不存在,K+ 一定存在
难度: 困难查看答案及解析
-
将CO2气体缓缓地通入到含KOH、Ba(OH)2和K[Al(OH)4]的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述不正确的是
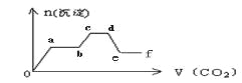
A. o—a段反应的化学方程式是:Ba(OH)2 + CO2 = BaCO3↓+ H2O
B. b—c段反应的离子方程式是:2[Al(OH)4]-+ CO2 = 2Al(OH)3↓ +CO32-+ H2O
C. a—b段与c—d段所发生的反应相同
D. d—e段沉淀的减少是由于碳酸钡固体的消失所致
难度: 中等查看答案及解析
-
向100mLpH=0的硫酸和硝酸混合溶液中投入3.84g铜粉,微热使反应充分完成后, 生成NO气体448mL(标准状况)。则反应前的混合溶液中含硫酸的物质的量浓度为( )
A.0.8mol·L-1 B.0.4mol·L-1 C.0.08mol·L-1 D.0.04mol·L-1
难度: 中等查看答案及解析