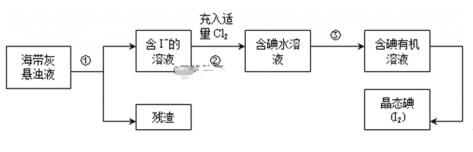
-
“纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质 ①是溶液 ②是胶体 ③能产生丁达尔效应 ④不能透过滤纸 ⑤能透过滤纸 ⑥静置后会析出黑色沉淀
A. ①④⑤ B. ②③④ C. ②③⑤ D. ①③④⑥
难度: 简单查看答案及解析
-
草酸(分子式为H2C2O4,沸点:150℃)是生物体的一种代谢产物,广泛分布于植物、动物和真菌体中.下列有关判断不正确的是( )
A. 45g草酸中含有1.204×1024个氧原子
B. 1mol草酸中含有6.02×1023个分子
C. 草酸的摩尔质量是90g·mol-1
D. 1mol草酸在标准状况下的体积约为22.4L
难度: 简单查看答案及解析
-
用0.2mol·L-1某金属阳离子Rn+的盐溶液40mL,恰好将20 mL0.4mol·L-1的硫酸盐中的硫酸根离子完全沉淀,则n值为
A. 1 B. 2 C. 3 D. 4
难度: 困难查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 1mol/L Na2SO4溶液含有2NA个Na+
B. 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
C. 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA
D. 18g NH4+所含电子数为11NA
难度: 简单查看答案及解析
-
下列溶液中c(Cl-)与50mL 1 mol/L的AlCl3溶液中的c(Cl-)相等的是
A. 150mL 1mol/L NaCl B. 75mL 2mol/L CaCl2
C. 150mL 3mol/L KClO3 D. 75mL 1mol/L FeCl3
难度: 简单查看答案及解析
-
下列中草药煎制步骤中,属于过滤操作的是( )
A.冷水浸泡
B.加热煎制
C.箅渣取液
D.灌装保存

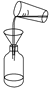
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列仪器中不能用于加热的是
A. 试管 B. 烧杯 C. 容量瓶 D. 蒸发皿
难度: 简单查看答案及解析
-
下列各组物质,按氧化物、混合物、单质、电解质顺序排列的是
A. 二氧化硫 、碘酒 、液态氧 、烧碱
B. 硫酸钾 、纯碱 、白磷 、生石灰
C. 氧化铜 、氯化氢 、钠 、干冰
D. 氧化钙 、胆矾 、氮气 、空气
难度: 简单查看答案及解析
-
随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止副食品氧化变质,延长食品的保质期,在包装袋中常放入抗氧化物质。下列不属于抗氧化物质的是
A. 生石灰 B. 亚硫酸钠(Na2SO3) C. 铁粉 D. 硫酸亚铁(FeSO4)
难度: 简单查看答案及解析
-
下列物质中,含有自由移动氯离子的是
①食盐溶液 ②盐酸 ③氯酸钾 ④液态氯化氢 ⑤熔融氯化钾
A. ①②③ B. ②③④ C. ③④⑤ D. ①②⑤
难度: 中等查看答案及解析
-
一定温度和压强下,30L某种气态纯净物中含有6.02×1023个分子,这些分子由1.204×1024个原子构成,下列有关说法不正确的是
A. 该温度和压强可能是标准状况
B. 标准状况下,该纯净物若为气态,其体积约是22.4L
C. 该气体中每个分子含有2个原子
D. 若O2在该条件下为气态,则1molO2在该条件下的体积也为30L
难度: 中等查看答案及解析
-
以下化学反应不属于氧化还原反应的是
A. 2Na+2H2O=2NaOH+H2 ↑ B. N2H4+O2=N2+2H2O
C. FeO+2HCl=FeCl2+H2O D. NO + NO2 + Na2CO3=2NaNO2 + CO2↑
难度: 简单查看答案及解析
-
某溶液中含有大量的下列离子:Mg2+、NO3—、K+和M离子,经测定Mg2+、NO3—、K+离子的物质的量之比为2︰4︰1,则M离子可能是下列中的
A. Cl— B. SO42- C. OH— D. Na+
难度: 中等查看答案及解析
-
下列说法中错误的是
A. Cu和NaOH溶液均能导电,故Cu和NaOH均为电解质
B. 500mL1mol/L的MgCl2溶液比100mL0.25mol/LKCl溶液的导电性强
C. NH3溶于水后,溶液能够导电,但NH3是非电解质
D. NaHSO4溶于水电离方程式为NaHSO4===Na++H++SO42-
难度: 中等查看答案及解析
-
对反应Al2O3+N2+3C
2AlN+3CO的叙述正确的是
A. Al2O3是氧化剂,C是还原剂 B. 每生成1 mol CO需转移2 mol电子
C. AlN中氮元素的化合价为+3 D. N2发生了氧化反应
难度: 简单查看答案及解析
-
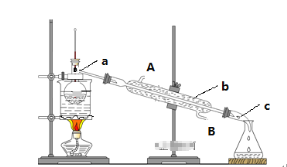
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
A.用CCl4提取溴水中的Br2
B.从KI和I2的固体混合物中回收I2
C.吸收NH3(极易溶于水),并防止倒吸
D.工业酒精制备无水酒精
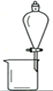

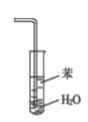
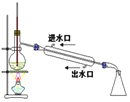
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用下图表示的一些物质或概念间的从属关系,其中不正确的是

选项
A
B
C
D
X
氧化物
酸、碱、盐
溶液
置换反应
Y
化合物
电解质
胶体
氧化还原反应
Z
纯净物
化合物
分散系
化学反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 饱和石灰水与稀硝酸反应:Ca(OH)2+2H+===Ca2++2H2O
B. 钠跟水反应:Na+2H2O===Na++2OH-+H2↑
C. 碳酸钡与稀硫酸反应: BaCO3+2H+===Ba2++CO2↑+H2O
D. 小苏打溶液与NaOH反应: HCO3-+OH-===H2O+CO32-
难度: 中等查看答案及解析
-
下面是某研究性学习小组对离子方程式 xR2+ + yH+ + O2 = mR3+ + nH2O的分析研究。在下面的各种说法中错误的是
A.可以根据氧化还原反应中电子得失守恒,得出x的值等于4的结论
B.可以根据原子守恒,得出x与m的数值一定相等的结论
C.可以根据电荷守恒,得出x与y的和一定等于m的结论
D.可以根据氧化还原反应中各种关系,得出R2+是还原剂,O2是氧化剂,R3+是氧化产物,H2O是还原产物的结论
难度: 困难查看答案及解析
-
下列离子组在指定溶液中一定能大量共存的是
A. 在酸性溶液中:I-、Cl-、SO42-、Fe3+
B. 使酚酞呈深红色的溶液中:Na+、Cl-、H+、NO3-
C. 含大量Ag+的溶液中:K+、Na+、NO3-、SO42-
D. 含大量OH-的溶液中:CO32-、Cl-、F-、K+
难度: 中等查看答案及解析
-
下列实验结论正确的是
A. 向某溶液中加入稀盐酸,产生无色无味的气体,将该气体通入澄清石灰水中,石灰水变浑浊,证明该溶液中一定含有CO32-
B. 向某溶液中加入碳酸钠溶液,产生白色沉淀,再加入稀盐酸,白色沉淀消失,证明该溶液中一定含有Ba2+
C. 向某溶液中加入CCl4,CCl4层显紫红色,证明该溶液中存在I-
D. 向某溶液中加入氯化钡溶液,有白色沉淀产生,再加入稀盐酸,沉淀不消失,则该溶液中可能含有Ag+或SO42-
难度: 中等查看答案及解析
-
某氯原子的质量为a g,12C原子的质量为b g,用NA表示阿伏加德罗常数的值,下列不正确的是
A. 该氯原子的摩尔质量为
g/mol B. x g该氯原子的物质的量是
mol
C. 1 mol该氯原子的质量是aNA g D. y g该氯原子所含的原子数为
NA
难度: 简单查看答案及解析
-
已知反应:① KClO3+6HCl=3Cl2+KCl+3H2O ② 2KBrO3+Cl2=Br2+2KClO3 ③ Cl2+2KBr=2KCl+Br2,下列说法正确的是
A. 上述三个反应都有单质生产,所以都是置换反应
B. 氧化性由强到弱的顺序为KBrO3 >KClO3 >Cl2 >Br2
C. 反应①中还原剂与氧化剂的物质的量之比为6∶1
D. 若反应②中有1 mol还原剂参加反应,则氧化剂得电子的物质的量为2 mol
难度: 中等查看答案及解析
-
某固体A在一定条件下可完全分解,生成B、C、D三种气体的混合物。反应方程式如下:2A=B↑+2C↑+3D↑,此时测得混合气体的相对平均分子质量为30,则固体A的相对原子质量为
A. 180g/mol B. 90g/mol C. 90 D. 180
难度: 简单查看答案及解析
-
下列溶液的物质的量浓度的计算正确的是
A. 标准状况下,a L NH3溶于1000 g水中,得到的溶液密度为b g•cm-3,(考虑溶液体积变化)则该溶液的物质的量浓度为
mol•L-1
B. 将100 mL 1.5 mol•L-1的NaCl溶液与200 mL 2.5 mol•L-1的NaCl溶液混合(忽略溶液体积变化),得到溶液的物质的量浓度为2 mol•L-1
C. V L Fe2(SO4)3溶液中含Fe3+m g,溶液中c(SO42-)是
mol•L-1
D. 某温度时,饱和NaCl溶液的密度为ρ g•cm-3,物质的量浓度为c mol/L,该溶液中NaCl的质量分数为
×100%
难度: 中等查看答案及解析