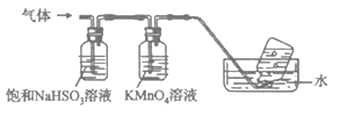
-
NA为阿伏加德罗常数,下列叙述中正确的是( )
A. 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
B. 标准状况下,6.72 L NO2与水充分反应转移的电了数目为0.1NA
C. 常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
D. 100g 46%的乙醇溶液中,含H-O键的数目为7NA
难度: 中等查看答案及解析
-
下列有关物质的应用与性质相对应的说法正确的有
①明矾能用于净水是因为铝离子水解生成的氢氧化铝胶体具有强氧化性
②氯化铁溶液可用于制作印刷电路板是因为其能氧化单质铜
③浓硫酸可用作干燥剂是因为其具有脱水性
④光导纤维可用作通讯材料是因为其具有导电性
⑤MgO、A12O3的熔点很高,可制作耐高温材料
⑥NaHCO3能与碱反应,因此食品工业上可用作焙制糕点的膨松剂
⑦A1具有良好的延展性和抗腐蚀性,可制成铝箔包装物品
A. 2个 B. 3个 C. 4个 D. 5个
难度: 中等查看答案及解析
-
加热N2O5,依次发生的分解反应为:①N2O5(g)
N2O3(g)+O2(g),②N2O3(g)
N2O(g)+O2(g)。在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol,则t℃时反应①的平衡常数为
A. 4.25 B. 8.5 C. 17 D. 22.5
难度: 困难查看答案及解析
-
可逆反应:3A(g)
3B(?)+C(?)△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
A. B和C可能都是固体 B. 若C为固体,则B一定是气体
C. B和C一定都是气体 D. B和C不可能都是气体
难度: 困难查看答案及解析
-
已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量Cl2,溶液中某些离子的物质的量变化如下图所示。下列说法中,不正确的是
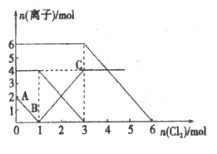
A. 还原性:I->Fe2+>Br-
B. 原混合溶液中FeBr2的物质的量为3mol
C. 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
D. 当通入3mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
难度: 困难查看答案及解析
-
下列离子方程式书写不正确的是
A. A1C13 溶液与烧碱溶液反应,当n(OH-) :n(A13+)=7 : 2 时,2A13++7OH-==A1(OH)3↓+ AlO2-+2H2O
B. 当向饱和Na2CO3溶液中通入过量CO2时,CO32-+CO2 + H2O==2HCO3-
C. CuCl2 溶液与 NaHS 溶液反应,当n(CuCl2):n(NaHS) = l : 2 时,Cu2++2HS-==CuS↓十H2S↑
D. ICl和Cl2的化学性质相似,将ICl通入KOH溶液中:ICl+2OH-═Cl-+IO-+H2O
难度: 困难查看答案及解析
-
下列说法不正确的是( )
A. 已知冰的熔化热为6.0 kJ • mol-1,冰中氢键键能为20 kJ • mol-1,假设1 mol 冰中有2 mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15 %的氢键
B. 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a, 电离常数
。若加水稀释,则CH3COOH
CH3C00-+H+向右移动,a增大, Ka不变
C. 甲烷的标准燃烧热为-890.3 kJ• mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ • mol-1
D. 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g)△H=-38.6kJ/mol
难度: 中等查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2g (已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是
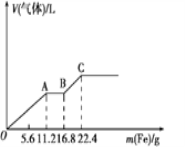
A. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
B. 原混合酸中SO42-物质的量为0.6 mol
C. 第二份溶液中最终溶质为FeSO4
D. 取20mL原混合酸加水稀释至1L后溶液的c(H+)=0.2mol/L
难度: 困难查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是
①通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3-
②pH=1的溶液Mg2+ 、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中Cl-、HCO3-、SO42-、NH4+
④由水电离的C(OH-)= 10-13 mol/L的溶液中,Na+、Ba2+、Cl-、Br-
⑤有较多的Fe3+的溶液中,Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中Fe3+、Al3+、NO3-、I-、Cl-
⑦Kw/c(H+) =10-13 mol·L-1溶液中:Fe3+、NH4+、Mg2+、SO42-
⑧NaHS溶液中:SO42-、K+、Cl-、Cu2+
A. ④⑦ B. ①③④ C. ①②⑦ D. ③⑤
难度: 中等查看答案及解析
-
已知A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系。下列说法错误的是

A. 若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染。则D转化成C的反应化学方程为3NO2+H2O=2HNO3+NO
B. 若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化。在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H 1、△H 2、△H 3,则它们之间的关系为△H 2=△H 1+△H 3
C. 若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融)
4Na+O2↑
D. 若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种气态非金属单质,实验室保存D溶液的方法是加入适量铁粉与适量盐酸
难度: 困难查看答案及解析
-
可逆反应①X(g)+2Y(g)
2Z(g)、②2M(g)
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦力、可自由滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
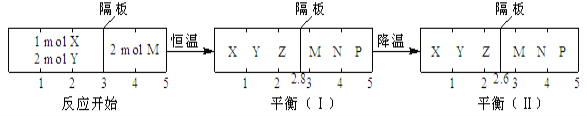
下列判断正确的是( )
A. 反应①的正反应是吸热反应
B. 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C. 达平衡(I)时,X的转化率为5/11
D. 在平衡(I)和平衡(II)中,M在隔板右边气体中的体积分数不变
难度: 困难查看答案及解析
-
下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
③在0.1 mol·L1氨水中滴加0.lmol·L1盐酸,恰好完全反应时溶液的pH=a,则由水电离产生的c(OH-)=l0-amol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤浓度相等的a、NH4HSO4溶液、b、NH4HCO3溶液、c、NH4Cl溶液中的c(NH4+):a >b>c
⑥NaHSO3溶液显酸性,c(Na+)>c(HSO3-)>c(H+)>c(OH-)>c(SO32-)
⑦常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
⑧pH=3.6的0.1mol/L HX与0.1mol/L NaX的混合溶液中,c(H+)-c(OH-)=c(X-)-c(HX)
A. ②④⑥⑦ B. ②⑤⑦⑧ C. ①③⑤⑥ D. ②⑤⑥⑧
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
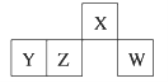
A. 原子半径:rW>rZ>rY>rX B. 含Y元素的盐溶液一定显酸性
C. 最简单气态氢化物的热稳定性:W>X D. Z的最高价氧化物的水化物难溶于水
难度: 中等查看答案及解析
-
a mol FeS与b mol FeO投入到V L、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63 g ②(a+b)×189 g ③ (Vc-
) mol ④
mol
A. ①④ B. ②③ C. ①③ D. ②④
难度: 困难查看答案及解析