-
下列有关铝及其化合物的性质说法正确的是
A. Al2O3熔点高,可用作耐高温材料
B. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,发现熔化后的液态铝滴落下来,所以金属铝的熔点较低
C. 把用砂纸打磨过的铝条放入浓硝酸中,产生红棕色气体
D. 把氯化铝溶液滴入浓氢氧化钠溶液中,产生大量白色沉淀
难度: 中等查看答案及解析
-
下列说法与“绿色思想”不符合的是 ( )
A. 启用大气中细颗粒物(PM2.5)的监测,以追根溯源,采取措施,改善空气质量
B. 开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题
C. 推广使用可降解塑料及布质购物袋,以减少“白色污染”
D. 为提高食品质量,禁止使用添加剂。
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列说法正确的是
A. 标准状况下,22.4L苯中含有的碳氢键数目为6NA
B. 标准状况下,22.4LNO与11.2L 的O2组成的混合气体中含有的原子数为3NA
C. 25℃时,pH=1的CH3COOH溶液中含有的H+数目等于0.1NA
D. 已知反应: Cu2S+O2
2Cu+SO2,每生成1molCu转移的电子数为2NA
难度: 中等查看答案及解析
-
已知磷酸分子(
 )中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是
)中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是A. H3 PO2属于三元酸 B. H3 PO2的结构式为
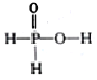
C. NaH2PO2属于酸式盐 D. NaH2PO2溶液可能呈酸性
难度: 困难查看答案及解析
-
下列解释事实的化学方程式或离子方程式不正确的是( )
A.钢铁发生吸氧腐蚀:2Fe+O2+2H2O=2Fe(OH)2
B.SO2使紫色石蕊溶液变红色:SO2+H2O=SO32-+2H+
C.利用NaOH溶液除去金属铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O
D.84消毒液和洁厕灵混合使用会产生有毒气体:Cl-+ClO-+2H+=Cl2↑+H2O
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 1.0 mol·L-1KNO3溶液:H+、Fe2+、SCN-、SO42-
B. c(H+)/c(OH-)=10-10的溶液:K+、Ba2+、NO3-、Cl-
C. pH=0的溶液:Al3+、Ag(NH3) 2-、Cl-、SO42-
D. c(ClO-)=1.0 mol·L-1的溶液:Na+、SO32-、S2-、SO42-
难度: 中等查看答案及解析
-
我们生活在千变万化的物质世界里。下列过程或变化中,没有发生氧化还原反应的是( )
A. 粗铜精炼 B. 铁锁镀铜 C. 浸泡在洪水中的铁门生锈 D. 醋酸电离
难度: 中等查看答案及解析
-
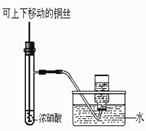
下列实验合理的是( )
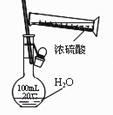
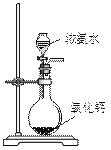
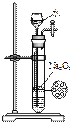
A、配制一定浓度硫酸
B、制备少量氨气
C、制备并收集少量NO2气体
D、制备少量氧气
难度: 中等查看答案及解析
-
下列做法不正确的是
A. Na2O2用作呼吸面具的供氧剂 B. NaHCO3的热稳定性大于Na2CO3
C. 乙醇可与金属钠反应放出氢气 D. 金属钠着火时,用细沙覆盖灭火
难度: 简单查看答案及解析
-
大功率的镍氢电池使用在油电混合动力车辆中。镍氢电池NiMH电池正极板材料为NiOOH,负极板材料为吸氢合金,下列关于该电池的说法中正确的的是
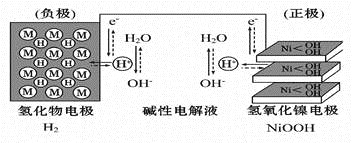
A. 放电时电池内部H+向负极移动
B. 充电时,将电池的负极与外接电源的正极相连
C. 充电时阳极反应为Ni(OH)2+ OH-- e-=NiOOH+H2O
D. 放电时负极的电极反应式为MHn-ne-= M+nH+
难度: 中等查看答案及解析
-
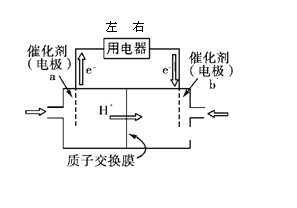
最近有研究人员发现了一种处理高浓度乙醛废水的新方法——隔膜电解法,实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,采用如图所示装置电解,电解后乙醛转化为乙醇和乙酸。则下列说法不正确的是( )
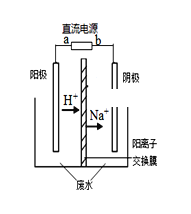
A. 阳极产物为乙酸,发生氧化反应
B. 电解时,阳极区附近pH 增大
C. 阴极反应式为CH3CHO+2H++2e-=CH3CH2OH
D. 若以CH4一空气燃料电池为直流电源,则燃料电池的a 极应通入空气
难度: 中等查看答案及解析
-
将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如右图所示。则下列说法不正确的是
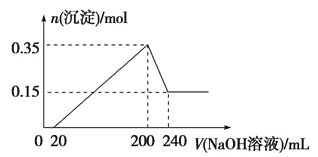
A. 镁和铝的总质量为9 g
B. 最初20 mLNaOH溶液用于中和过量的硫酸
C. 硫酸的物质的量浓度为2.5 mol·L-1
D. 生成的氢气在标准状况下的体积为11.2 L
难度: 中等查看答案及解析
-
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2−、MnO4−、CO32−、SO42−中的若干种组成,取该溶液进行如下实验:
①取适量试液,加入过量盐酸,有气体生成,并得到澄清溶液;
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成;同时析出白色沉淀甲;
③在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据对上述实验的分析判断,最后得出的结论合理的是( )
A. 不能判断溶液中是否存在SO42− B. 溶液中一定不存在的离子是CO32−
C. 不能判断溶液中是否存在Ag+ D. 不能判断是否含有 AlO2− 离子
难度: 困难查看答案及解析
-
下列各组物质反应时,改变反应条件或者反应物的物质的量之比,生成的产物不变的是( )
A. Na与氧气
B. 澄清石灰水与二氧化碳
C. Al与稀盐酸
D. 氯化铝溶液与氢氧化钠溶液
难度: 中等查看答案及解析