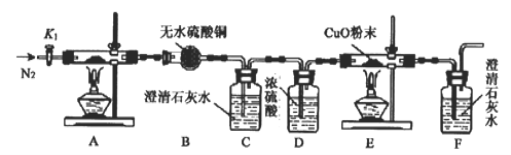
-
制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。常温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A. 通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42-
B. 加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO-
C. 加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH-
D. 加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH-
难度: 困难查看答案及解析
-
已知NH4CuSO3与足量的10 mol/L硫酸混合微热,产生下列现象:①有红色金属生成
②产生刺激性气味的气体 ③溶液呈现蓝色。请你据此判断下列说法正确的是
A. 反应中硫酸作氧化剂
B. NH4CuSO3中硫元素被氧化
C. 刺激性气味的气体是氨气
D. 1 mol NH4CuSO3完全反应转移0.5 mol电子
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4 L CCl4中含CCl4分子数为NA
B. 5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等
C. 0.1 mo1·L-1 MgCl2溶液中含Cl-数为0.2NA
D. 3.9 g Na2O2 晶体中含有的离子总数为0.2NA
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B. 江河入海口三角洲的形成通常与胶体的性质有关
C. 用激光笔检验淀粉溶液的丁达尔效应
D. 向煮沸的1 mol·L-1NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
难度: 简单查看答案及解析
-
下列离子方程式的书写及评价均合理的是( )
选项
离子方程式
评价
A
将2 mol Cl2通入含1 mol FeI2的溶液中:
2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2
正确;Cl2过量,可将Fe2+、I-均氧化
B
Ba(HCO3)2溶液与足量的NaOH溶液反应:
Ba2++HCO3-+OH-===BaCO3↓+H2O
正确;酸式盐与碱反应生成正盐和水
C
过量SO2通入NaClO溶液中:
SO2+H2O+ClO-===HClO+HSO3-
正确;说明酸性:H2SO3强于HClO
D
1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合:
2AlO2-+5H+===Al3++Al(OH)3↓+H2O
正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )
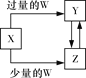
选项
W
X
A
稀硫酸
NaAlO2溶液
B
稀硝酸
Fe
C
CO2
Ca(OH)2溶液
D
Cl2
Fe
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在200 mL含Mg2+、Al3+、NH4+、H+、Cl―等离子的溶液中,逐滴加入5mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述不正确的是

A. x与y的差值为0.01 mol
B. 原溶液中c(Cl―)=0.75 mol·L-1
C. 原溶液的pH=1
D. 原溶液中n(Mg2+)∶n(Al3+)=5∶1
难度: 中等查看答案及解析