-
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是
A.2SO2(g)+O2(g)
2SO3(g) ΔH=-196.6 kJ·mol-1
B.2SO2(g)+O2(g)
2SO3(g) ΔH=-98.3 kJ·mol-1
C.SO2(g)+
O2(g)
SO3(g) ΔH=+98.3 kJ·mol-1
D.SO2(g)+
O2(g)
SO3(g) ΔH=-196.6 kJ·mol-1
难度: 中等查看答案及解析
-
某烃不与溴水反应,能使酸性高锰酸钾溶液褪色,在Fe存在下与Cl2反应,能生成两种一氯代物,该烃是
A.CH≡C—CH3 B.对二甲苯
C.对甲乙苯 D.邻甲乙苯
难度: 中等查看答案及解析
-
500 mL 1 mol/L的稀HCl与锌粒反应,不会使反应速率加快的是
A.升高温度
B.将500 mL 1 mol/L的HCl改为1000 mL 1 mol/L的HCl
C.用1 mol/L的H2SO4代替1 mol/L的HCl
D.用锌粉代替锌粒
难度: 中等查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应达平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
难度: 中等查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g)(正反应吸热),下列图象中正确的是

难度: 中等查看答案及解析
-
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液(c=0.1 mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则
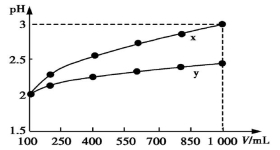
A.x为弱酸,Vx<Vy B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy D.y为强酸,Vx>Vy
难度: 中等查看答案及解析
-
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.①③ C.②④ D.③④
难度: 中等查看答案及解析
-
降低温度时,下列数据不一定减小的是
A.化学反应速率v
B.溶度积常数Ksp
C.水解平衡常数Kh
D.水的离子积常数Kw
难度: 中等查看答案及解析
-
已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
难度: 中等查看答案及解析
-
常温下的下列溶液,有关说法正确的是
A.某酸H2A的钠盐NaHA溶液中:c(A2-) < c(H2A),则该溶液的pH>7
B.1.0×10-3 mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0
C.在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
D.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同
难度: 中等查看答案及解析
-
室温下,将pH=3的H2SO4溶液和pH=12的NaOH溶液混合,当混合溶液的pH=10时,强酸和强碱的体积之比为
A.1∶9 B.9∶1 C.10∶1 D.1∶10
难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡:H2O
H++OH- ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
难度: 中等查看答案及解析
-
下列溶液中离子浓度关系的表示正确的是
A.NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-)
B.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后的溶液中:c(OH-)>c(H+)+c(CH3COO-)
C.0.1 mol·L-1的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2c(Na+)=c(CH3COOH)+c(CH3COO-)
难度: 中等查看答案及解析
-
下列有关AgCl沉淀的溶解平衡的说法中,正确的是
A.升高温度,AgCl的溶解度减小
B.在任何含AgCl固体的水溶液中,c(Ag+)=c(Cl-)且二者乘积是一个常数
C.AgCl沉淀生成和溶解不断进行,但速率相等
D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解的质量不变
难度: 中等查看答案及解析
-
电子表所用的某种纽扣电池的电极材料为Zn和Ag2O,电解质溶液是KOH溶液。电池总反应式为:Zn+Ag2O=ZnO+2Ag,下列说法错误的是
A.该电池工作时,电解质中的阴离子向负极移动
B.该电池负极的电极反应式为:Zn+2OH--2e-=ZnO+H2O
C.理论上该电池工作一段时间后,溶液中KOH的浓度不变
D.该电池的正极是Zn,负极是Ag2O
难度: 中等查看答案及解析
-
如图,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色.则下列说法正确的是
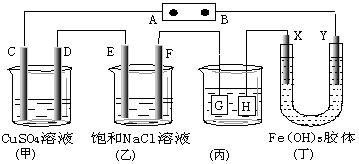
A.若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:O2+2H2O+4e-=4OH-
B.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
C.(丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
D.C、D、E、F电极均有单质生成,其物质的量比为1∶1∶2∶2
难度: 困难查看答案及解析
 线与直流电源相连。请回答以下问题:
线与直流电源相连。请回答以下问题: