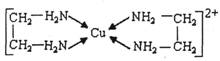
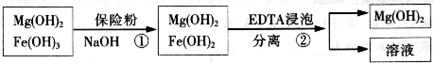-
生活中的一些问题常涉及到化学知识,下列叙述不正确的是 ( )
A.维生素C具有还原性,在人体内起抗氧化作用
B.“加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子
C.日本大地震后,防疫人员在震区周围撒石灰,进行环境消毒,防止灾后出现疫情。
D. 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁。
难度: 中等查看答案及解析
-
下列化学用语表达正确的是 ( )
A.氯化钠的电子式
:
B.丙烷分子的比例模型:
C.NaHCO3的电离方程式NaHCO3=Na++H++CO32-
D.质子数为53,中子数为78的碘原子:131 53I
难度: 中等查看答案及解析
-
下列有关物质的性质叙述不正确的是 ( )
A.蛋白质水解的最终产物都是α—氨基酸
B.臭氧可用于自来水的消毒,是由于臭氧具有强的氧化性
C.工业上生产氨气时可以用分离出氨气的方法提高转化率,是利用氨易液化的性质
D.氧化铝能与氢氧化钠溶液反应,又能与盐酸反应,是因为氧化铝是两性氧化物
难度: 中等查看答案及解析
-
用NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.12g金刚石中所含的共价键数为4NA
B.标准状况下,11.2L SO3所含的氧原子数为1.5NA
C.常温下,1L0.1mol/L的NH4NO3溶液中铵根离子为0.1 NA
D.1mol 过氧化氢分解转移NA电子
难度: 中等查看答案及解析
-
下列离子组一定能够大量共存的是 ( )
A.含ClO-的溶液中:Fe3+、S042-、NO3-、K+
B.使石蕊试液显红色的溶液中:Fe2+、K+、NO3-、CI-
C.在c(H+)∶c(OH-)=1∶1012的溶液中,Na+、I-、NO3-、SO42-
D.能使有色布条褪色的溶液:K+、S032-、NO3-、Mg2+
难度: 中等查看答案及解析
-
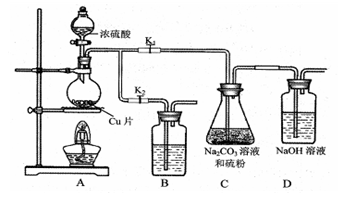
用下列实验装置进行的实验,能达到相应的实验目的的是 ( )
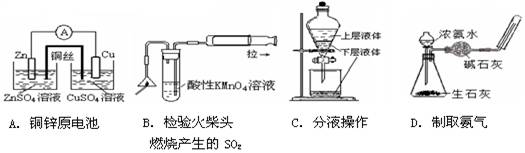
难度: 中等查看答案及解析
-
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。则下列有关说法中正确的是 ( )
A.X的氢化物溶于水显酸性 B.Z的氧化物的水化物一定是强酸
C.Y的氧化物是离子化合物 D.X和Z的最高价氧化物对应的水化物都是弱酸
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是 ( )
A.金属钠投入水中: Na + H2O
Na+ + OH- + H2↑
B.足量铁加入少量稀硝酸中: Fe + 4H+ + NO3-
Fe3+ + NO↑+ 2H2O
C.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液
D.用银氨溶液检验乙醛中的醛基:
CH3CHO+2[Ag(NH3)2]++2OH-CH3COO-+NH4++3NH3+2Ag↓+H2O
难度: 中等查看答案及解析
-
NaCI是一种化工原料,可以制备一系列物质 (见下图)。下列说法正确的是 ( )
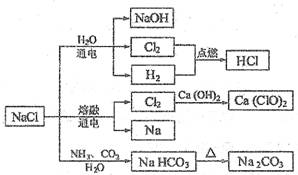
A.常温时,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应可用于制备漂白粉,漂白粉的主要成分是Ca(ClO)2和CaCl2
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图中所示转化反应都是氧化还原反应
难度: 中等查看答案及解析
-
按规定在食盐中添加一定量的碘化钾(KIO3)即成为可以为人体补充碘元素的“加碘食盐”。KIO3可用在一定温度下电解KI水溶液的方法制得。以下关于这一生产得叙述正确的是( )
A. KIO3在阳极产生,阴极产物为H2
B.可以用不锈钢棒作两个电极的材料
C. 产生IO3-离子的电极周围溶液pH增大
D. 溶液中阳离子向阳极移动
难度: 中等查看答案及解析
-
头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应极小,因而被广泛适用于敏感细菌所致的尿路感染、皮肤软组织感染以及急性扁桃体炎、急性咽炎、中耳炎和肺部感染等的治疗。已知肽键可以在碱性条件下水解。下列对头孢羟氨苄的说法中正确的是 ( )
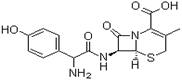
A.头孢羟氨苄的化学式为C16H16N3O5S·H2O
B. 1mol头孢羟氨苄与NaOH溶液和浓溴水反应时,分别需要消耗NaOH 4mol和Br2 3mol
C.在催化剂存在的条件下,1mol头孢羟氨苄消耗7molH2
D. 头孢羟氨苄能在空气中稳定存在
难度: 中等查看答案及解析
-
下列有关化学反应现象或化学原理的解释正确的是 ( )
选项
现象或反应
原理解释
A
KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去
SO2具有漂白性
B
合成氨反应需在高温条件下进行
该反应为吸热反应
C
蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处
此位置指示的是被蒸馏物质的沸点
D
2CO=2C+O2在任何条件下均不能自发进行
该反应△H>0,△S<0
难度: 中等查看答案及解析
-
下列推断或表述正确的是( )
A.因为氯化铝是分子晶体,所以工业制备金属铝不采用电解氯化铝溶液,但工业制取金属镁可以采用电解氯化镁溶液的方法
B.25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体c(Mg2+)增大
C.鸡蛋清中加入2滴1%醋酸铅溶液后会产生沉淀,因为蛋白质发生了变性。
D.在BaSO4悬浊液中加入饱和碳酸钠溶液,过滤、洗涤得固体,再加盐酸产生气体。可证明Ksp(BaSO4)<Ksp(BaCO3)
难度: 中等查看答案及解析
-
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下向10mL 0.01mol·L—1NaHC2O4溶液中滴加0.01mol·L—1NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
A.V(NaOH) = 0时,c(H+)=1×10—2mol·L—1
B.V(NaOH) <10mL时, 可能存在c(Na+)=2c(C2O42-)+c(HC2O4- )
C.V(NaOH) = 10 mL时, c(H+) = 1×10—7mol·L—1
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- )
难度: 中等查看答案及解析
-
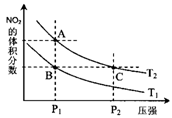
在溶液中,反应A+2B
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol·L-1,c(B)=0.200 mol·L-1 ,c(C)=0 mol·L-1。反应物A的浓度随时间的变化如右图所示。下列说法正确的是 ( )
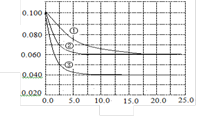
A.反应A+2B
C的△H>0
B.若反应①、②的平衡常数分别为K1、K2,则K1< K2
C.实验②平衡时B的转化率为60%
D.减小反应③的压强,可以使平衡时c(A)=0.060 mol·L-1
难度: 中等查看答案及解析