-
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是
A. 常温常压下X的单质为气态
B. Z的氢化物为离子化合物
C. Y和Z形成的化合物的水溶液呈碱性
D. W与Y具有相同的最高化合价
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A. 0.1 mol·L-1KI溶液:Na+、K+、ClO-、OH-
B. 0.1 mol·L-1Fe2(SO4)3溶液:Cu2+、N
、N
、S
C. 0.1 mol·L-1HCl溶液:Ba2+、K+、CH3COO-、N
D. 0.1 mol·L-1NaOH溶液:Mg2+、Na+、S
、HC
难度: 中等查看答案及解析
-
为了使宇航员在飞船中得到一个稳定的,良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是 ( )
A. Na2O2中阴、阳离子的个数比为1∶1
B. Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C. Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等
D. Na2O2的漂白原理与SO2的漂白原理相同
难度: 简单查看答案及解析
-
研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
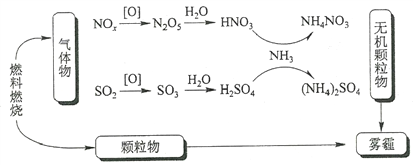
A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
难度: 简单查看答案及解析
-
我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na
2Na2CO3+C。下列说法错误的是( )。
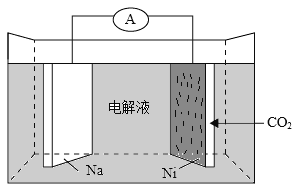
A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e-=2CO32-+C
D. 充电时,正极反应为:Na++e-=Na
难度: 中等查看答案及解析
-
室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
难度: 中等查看答案及解析
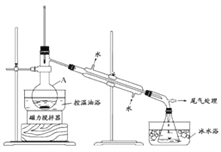


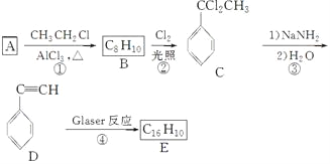
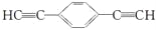 )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为___________________________________________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为___________________________________________________________________。