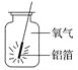
-
据中央电视台报道,近年来我国的一些沿江城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列哪种分散系( )
A. 乳浊液 B. 溶液 C. 胶体 D. 悬浊液
难度: 简单查看答案及解析
-
在同温同压下,相同体积的烧瓶分别充满氨气和氯化氢气体,做喷泉实验后,水都充满烧瓶(假设溶液充满整个烧瓶,且溶质不扩散),烧瓶中所得溶液的物质的量浓度之比是( )
A. 1∶0.45 B. 1∶1 C. 1∶0.29 D. 4.5∶2.9
难度: 中等查看答案及解析
-
已知下列几个反应的化学方程式:① 2KI+Cl2=2KCl+I2、② 2FeCl2+Cl2=2FeCl3、③ 2FeCl3+2HI=2FeCl2+I2+2HCl,下列有关物质的氧化性的强弱排列顺序中正确的是
A.Cl2>Fe3+>I2 B.Cl2>I2>Fe3+
C.Fe3+>Cl2>I2 D.Fe3+>I2>Cl2
难度: 简单查看答案及解析
-
如图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是
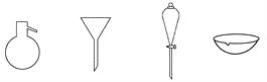
A. 蒸馏、蒸发、萃取、过滤 B. 过滤、蒸发、萃取、蒸馏
C. 萃取、过滤、蒸馏、蒸发 D. 蒸馏、过滤、萃取、蒸发
难度: 中等查看答案及解析
-
下列对浓硫酸的叙述正确的是( )
A. 常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸
B. 浓硫酸具有强氧化性,SO2、H2、CO具有还原性,故浓硫酸不能干燥SO2、H2、CO
C. 浓硫酸和铜片加热既表现出酸性,又表现出氧化性
D. 浓硫酸与亚硫酸钠反应制取SO2时,浓硫酸表现出强氧化性
难度: 中等查看答案及解析
-
检验氯离子的试剂是稀硝酸和硝酸银溶液,加入过量稀硝酸的目的是( )
A. 排除碳酸根离子的干扰 B. 排除硫酸根离子的干扰
C. 生成白色沉淀 D. 排除硝酸根离子的干扰
难度: 中等查看答案及解析
-
下列有关物质的分离说法正确的是( )
A. 可用加热法分离氯化钠和碳酸钙
B. 蒸馏和蒸发都用来分离液体混合物
C. 工业上制无水酒精通常是将生石灰与95%酒精混合后蒸馏
D. 碘水中加四氯化碳振荡静置后,上层为紫色,下层几乎为无色
难度: 中等查看答案及解析
-
将一小块钠投入盛有饱和硝酸钾溶液(含有酚酞)的试管里,不可能观察到的现象是( )
A. 熔成小球并在液面上游动 B. 有气体生成
C. 溶液变为红色 D. 溶液变浑浊
难度: 中等查看答案及解析
-
下列实验所选装置不合适的是( )
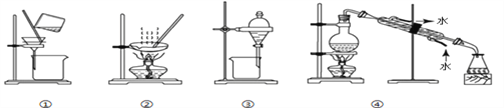
A. 分离水和泥沙选① B. 从盐水中获得食盐选②
C. 分离酒精和水选③ D. 由自来水制取纯净水选④
难度: 中等查看答案及解析
-
证明某溶液中只含有Fe2+而不含有Fe3+的实验方法是( )
A. 先滴加氯水,再滴加KSCN溶液后显红色
B. 只需滴加KSCN溶液
C. 先滴加KSCN溶液,不显红色,再滴加氯水后显红色
D. 滴加酸性高锰酸钾溶液后溶液褪色
难度: 中等查看答案及解析
-
下列图示的四种实验操作名称从左到右依次是
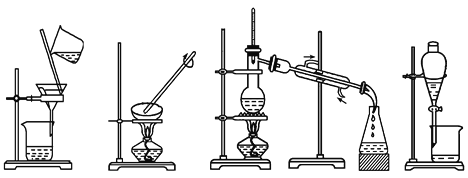
A. 过滤、蒸发、蒸馏、分液 B. 过滤、蒸馏、蒸发、分液
C. 蒸发、蒸馏、过滤、分液 D. 分液、蒸馏、蒸发、过滤
难度: 中等查看答案及解析
-
将一定质量的锌、铝混合物与足量的稀硫酸反应,生成2.8 L(标况)氢气,原混合物的质量可能是( )
A. 2 g B. 1 g C. 8 g D. 10 g
难度: 中等查看答案及解析
-
在反应3BrF3+5H2O===HBrO3+Br2+9HF+O2↑中,若有5 mol H2O作为还原剂时,被还原的BrF3的物质的量为( )
A. 3 mol B. 2 mol C.
mol D.
mol
难度: 中等查看答案及解析
-
漂白粉主要成分可用下式表示:
Ca(OH)2·3CaCl(ClO)·nH2O,用过量的盐酸和漂白粉作用可生成Cl2。Cl2与漂白粉的质量比叫做漂白粉的“有效氯”。现有一种漂白粉的“有效氯”为0.355,则式中的n值约为
A、7.5 B、8.0 C、9.5 D、11.0
难度: 中等查看答案及解析
-
下列各物质所含原子数目按由大到小顺序排列的是( )
①0.6 mol NH3 ②0.2 mol H3PO4③9 g H2O ④标准状况下22.4 L He
A. ①②③④ B. ②③①④ C. ②①③④ D. ①②④③
难度: 中等查看答案及解析
-
实验室贮存下列物质的溶液时,必须用棕色瓶的是( )
①浓硝酸 ②浓硫酸 ③浓盐酸 ④硝酸银溶液
A. ①④ B. ②③ C. ①③ D. ②④
难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A. 分离氯化钠和氯化银的混合物,可用蒸馏法
B. 从碳酸钠溶液中得到碳酸钠,可用过滤法
C. 分离酒精与四氯化碳的混合物,可用蒸馏法
D. 从碘的四氯化碳溶液中得到四氯化碳,可用萃取法
难度: 中等查看答案及解析
-
由反应Na2SiO3+2HCl===2NaCl+H2SiO3↓制取硅酸,不可能的反应原理是( )
A. 强酸制取弱酸的原理
B. 可溶性酸制取难溶性酸的原理
C. 溶液中离子结合生成沉淀的原理
D. 氧化还原反应的原理
难度: 中等查看答案及解析
-
11.2 g铁粉与2.2 g硫粉均匀混合,在密闭容器中加热,冷却后加入足量盐酸,在标准状况下收集到气体的体积是( )
A. 11.2 L B. 5.6 L C. 4.48 L D. 2.24 L
难度: 中等查看答案及解析
-
铝是重要的金属材料之一,下列关于铝的叙述中,不正确的是 ( )
A. 铝原子最外层有3个电子
B. 铝是地壳中含量最多的金属元素
C. 在常温下,铝不能与氧气反应
D. 铝易被氧化,而Al3+则很难被还原
难度: 中等查看答案及解析
-
侯德榜是我国杰出的化学家,由他创立的“侯氏制碱法”中有这样一个反应:2NaHCO3
Na2CO3+H2O+x,则x的化学式是( )
A. CO B. CO2 C. H2 D. CH4
难度: 中等查看答案及解析
-
下列逻辑关系图中正确的是( )
A.
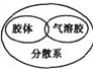 B.
B. 
C.
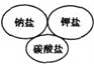 D.
D. 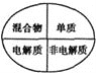
难度: 中等查看答案及解析
-
下列关于物质的量的表述中错误的是( )
A. 0.3 mol硝酸 B. 1.5 mol氧气 C. 1 mol氮 D. 0.5 mol氦原子
难度: 中等查看答案及解析
-
当光束通过下列分散系时,能产生丁达尔效应的是( )
A. 豆浆 B. 食盐水 C. 碘酒 D. 蔗糖水
难度: 简单查看答案及解析
-
下列说法中不正确的是( )
A. 天然二氧化硅俗称硅石 B. 石英的主要成分是二氧化硅
C. 水晶是无色透明的石英晶体 D. 自然界中存在大量的单质硅
难度: 中等查看答案及解析