-
为了检验某FeCl2溶液是否变质,应选用的试剂是
A. NaOH溶液 B. KSCN溶液 C. 铁片 D. 石蕊试液
难度: 简单查看答案及解析
-
将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A. 2︰3 B. 3︰2 C. 1︰2 D. 1︰1
难度: 简单查看答案及解析
-
下列各组物质的无色溶液,不用其他试剂即可鉴别的是
①NaOH、AlCl3 ②NaHCO3、H2SO4 ③NaAlO2、NaHSO4 ④Na2CO3、HCl ⑤Na2CO3、Ca(OH)2
A. ①②③④ B. ②④⑤ C. ①③④ D. 全部
难度: 中等查看答案及解析
-
将金属钠分别投入到下列溶液中,溶液质量增加的是
A. FeCl3溶液 B. K2SO4溶液 C. MgCl2溶液 D. 饱和NaOH溶液
难度: 中等查看答案及解析
-
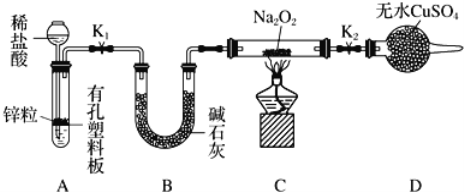
将26.4 g Na2O与Na2O2的混合物投入足量的水中溶解,反应后水溶液增重24.8 g,则原混合物Na2O与Na2O2的物质的量之比是
A. 1:3 B. 3:1 C. 13:31 D. 31:13
难度: 困难查看答案及解析
-
甲、乙两烧杯中各盛有100 mL 3 mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉质量为( )
A. 2.7 g B. 3.6 g C. 5.4 g D. 1.8 g
难度: 中等查看答案及解析
-
下列说不正确的是
A. 金属钠有强还原性,能和硫酸铜溶液反应,析出金属铜
B. 用Al(OH)3治疗胃酸过多
C. 过氧化钠可用于呼吸面具中作为氧气的来源
D. 绚丽缤纷的烟花中添加了含钾、钙、钠、铜等金属元素化合物
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法中不正确的是
A. 7.8 g Na2O2与足量CO2完全反应时转移电子数为0.1NA
B. 25℃时,0.1 mol·L-1 Na2S溶液中含有Na+的数目为0.2NA
C. 一定条件下,1.0 mol Cl2与足量铁完全反应转移电子数为2NA
D. 2.3 g Na与O2完全反应生成3.6 g产物时失去的电子数为0.1NA
难度: 简单查看答案及解析
-
用下列装置不能达到相关实验目的的是
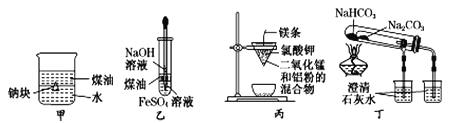
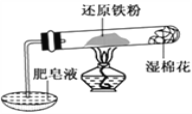
A. 用乙图装置制备Fe(OH)2
B. 用甲图装置证明:ρ(煤油)<ρ(钠)<ρ(水)
C. 用丙图装置制取金属锰
D. 用丁图装置比较NaHCO3和Na2CO3的热稳定性
难度: 简单查看答案及解析
-
在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是
A. NH4+、SO42-、CO32-、K+ B. Na+、Ba2+、Ca2+、HCO3-
C. Mg2+、SO42-、K+、Cl- D. K+、Cl-、Na+、SO42-
难度: 中等查看答案及解析
-
将过量过氧化钠投入到氯化亚铁溶液中,可观察到的现象是
A. 只有气泡产生 B. 生成灰绿色沉淀
C. 生成白色沉淀 D. 生成红褐色沉淀并有气泡产生
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 少量AlCl3溶液滴入过量的NaOH溶液中:Al3++4OH-= AlO2-+2H2O
B. 将一小块金属钠投入到硫酸铜溶液中:2Na+Cu2+=Cu+2Na+
C. FeCl3溶液与Cu反应:Fe3++Cu=Fe2++Cu2+
D. 向AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
难度: 简单查看答案及解析
-
下列实验过程不可以达到实验目的的是( )
编号
实验目的
实验过程
A
探究维生素C的还原性
向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
B
比较金属镁和铝的活泼性
分別向两只盛有等体积等浓度的稀硫酸烧杯中加入打磨过的同样大小的镁片和铝片,比较反应现象
C
比较Fe3+和I2的氧化性强弱
向淀粉碘化钾溶液中滴入氯化铁溶液,溶液变蓝色
D
检验NaHCO3 与Na2CO3 溶液
用小试管分别取少量溶液,然后滴加澄清石灰水
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是
选项
A
B
C
D
X
FeCl2溶液
FeCl3溶液
Fe
Al2O3
Y
FeCl3
CuCl2
Al
Fe2O3
Z
Cl2
Fe
NaOH溶液
NaOH溶液
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合溶液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )
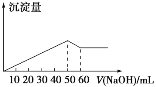
A. 6∶1 B. 3∶1 C. 2∶1 D. 1∶2
难度: 困难查看答案及解析
-
下列各项操作中符合“先出现沉淀后沉淀完全溶解”现象的有( )组
①向饱和碳酸钠溶液中通入CO2 至过量
②向Fe(OH)3胶体中逐滴滴加稀H2SO4至过量
③向BaCl2溶液中通入CO2 至过量
④向澄清石灰水中逐渐通入CO2至过量
⑤向Al2(SO4)3溶液中逐滴滴加Ba(OH)2至过量
⑥向NaAlO2溶液中逐滴滴加盐酸至过量
⑦向NaAlO2溶液中逐渐通入CO2至过量
⑧向NaOH溶液中逐滴滴加AlCl3至过量
A. 2 B. 3 C. 4 D. 5
难度: 中等查看答案及解析
-
下列实验与对应示意图的关系正确的是( )
A
B
C
D
向NaAlO2溶液中逐滴滴加盐酸至过量
向AlCl3溶液中逐滴滴加氨水至过量
向明矾溶液中逐滴滴加
Ba(OH)2溶液至过量
向澄清石灰水中缓缓通入CO2至过量
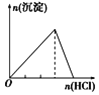

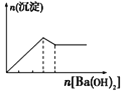
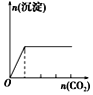
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列各组物质中,存在X→Y或Y→Z不能通过一步反应完成转化的一组是
选项
X
Y
Z
A
Al
NaAlO2(aq)
Al(OH)3
B
MgO
MgCl2(aq)
Mg
C
H2O(g)
Fe3O4
Fe
D
NaOH(aq)
Na2CO3(aq)
NaHCO3(aq)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将100 mL 2 mol/L AlCl3溶液跟一定体积4 mol/L NaOH溶液混合后可得7.8 g沉淀,则NaOH溶液的体积可能是:①75 mL ②150 mL ③175 mL ④200 mL
A. ① B. ② C. ①③ D. ②③
难度: 困难查看答案及解析
-
下列说法中不正确的是
A. 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
B. 用洁净的铂丝蘸取待测液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色,该溶液中一定含有钾离子,不含有钠离子
C. 除去FeCl2溶液中混有的FeCl3,可加入过量铁粉,再过滤
D. 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制氯水,溶液变红,则该溶液中一定含有Fe2+
难度: 中等查看答案及解析
-
下列有关铁及其化合物的说法中不正确的是
A. 为了防止氯化亚铁溶液久置变质,常在其溶液中加入少许铁钉
B. 将饱和FeCl3溶液滴入沸水中,能形成胶体
C. 新制的氢氧化亚铁沉淀露置在空气中最终会变为红褐色
D. 除去FeCl3溶液中的FeCl2杂质可以向溶液中加铁粉,然后过滤
难度: 中等查看答案及解析
-
在b L Al2(SO4)3和(NH4)2SO4的混合溶液中加入a mol BaCl2,恰好使溶液中的SO42-﹣离子完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为
A. (2a-c)/b B. (2a-c)/2b C. (2a-c)/3b D. (2a-c)/6b
难度: 简单查看答案及解析
-
某溶液中可能含有H+、Mg2+、NH4+、Al3+、Fe3+、CO32—、SO42—中的几种。若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
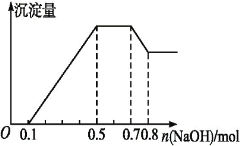
A. 溶液中的阳离子有H+、Mg2+、NH4+、Al3+
B. 溶液中n(Al3+)=0.1 mol
C. 溶液中一定不含CO32—,可能含有SO42—
D. n(H+)∶n(Al3+)∶n(Mg2+)=2∶2∶1
难度: 中等查看答案及解析
-
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
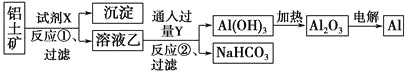
下列叙述正确的是 ( )。
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
难度: 中等查看答案及解析