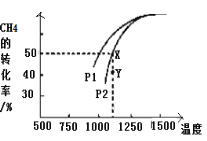
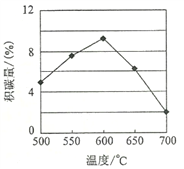
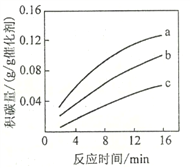
-
下列说法中正确的是
A. 凡是放热反应都是自发的,吸热反应都是非自发的
B. 自发反应一定是熵增大,非自发反应一定是熵减小或不变
C. 熵增加且放热的反应一定是自发反应
D. 非自发反应在任何条件下都不能实现
难度: 中等查看答案及解析
-
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A. 溶液中导电粒子的数目增加,导电性增强
B. 醋酸的电离程度增大,c(H+)亦增大
C. 再加入10mL pH=11 NaOH溶液,混合液pH=7
D. 溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]不变
难度: 简单查看答案及解析
-
根据键能数据估算CH4(g)+4F2(g)═CF4(g)+4HF(g)的反应热△H为
化学键
C—H
C—F
H—F
F—F
键能/(kJ
mol-1)
414
489
565
155
A. -485 kJ
mol-1 B. +485 kJ
mol-1 C. +1940 kJ
mol-1 D. -1940 kJ
mol-1
难度: 简单查看答案及解析
-
在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应:A(s)+2B(g)
C(g)+D(g)已达到平衡状态的现象是
A. 混合气体的压强 B. 混合气体的密度
C. 气体的总物质的量 D. 单位时间内生成n mol C的同时消耗2n molB
难度: 中等查看答案及解析
-
沼气是一种能源,它的主要成份是CH4,常温下0.5molCH4完全燃烧生成CO2和水时,放出445kJ热量,则下列热化学方程式中正确的是
A. 2CH4(g)+4O2(g)=2CO2(g)+4H2O(g) ΔH=+890kJ·mol-
B. CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=+445kJ·mol-
C. CH4(g)+2O2(g)= CO2(g)+2H2O(l) ΔH=-890kJ·mol-
D. 2CH4(g)+4O2(g)=2CO2(g)+4H2O(l) ΔH=-890kJ·mol-
难度: 中等查看答案及解析
-
常温下,已知Ksp(AgCl) > Ksp(AgBr),现将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,下列说法不正确的是
A. 根据Ksp(AgCl) > Ksp(AgBr),可知AgCl的溶解能力比AgBr强
B. 加入足量浓AgNO3溶液后,AgCl和AgBr的溶度积Ksp均不变
C. 加入足量浓AgNO3溶液后,溶液中只有AgBr沉淀
D. 在含有AgBr、AgCl固体的悬浊液中,c(Cl-) > c(Br-)
难度: 中等查看答案及解析
-
向 10 mL pH=12的某碱溶液中加入10 mL pH=2的盐酸,充分反应后滴入酚酞试液,溶液变红,则此碱一定是
A. 一元强碱 B. 多元强碱 C. 弱碱 D. 任何强碱
难度: 简单查看答案及解析
-
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。已知:
CH3OH(l)+O2(g)===CO(g)+2H2O(g) ΔH1=-443.64kJ/mol
2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0kJ/mol
下列说法或热化学方程式正确的是
A. CO的燃料热为-566.0kJ/mol
B. 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低
C. 完全燃烧32 g 甲醇,生成二氧化碳和水蒸气时放出的热量为908.3kJ
D. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1453.28kJ/mol
难度: 简单查看答案及解析
-
2.0 molPCl3和1.0 molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+ Cl2(g)
PCl5(g)达到平衡时, PCl5为0.40 mol,如果此时移走1.0 molPCl3和0.50 molCl2,在相同温度下再达平衡时 PCl5的物质的量是
A. 0.40 mol B. 小于0.20 mol C. 0.20 mol D. 大于0.20 mol,小于0.40 mol
难度: 困难查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g ),在不同情况下测得反应速率,其中反应速率最快的是( )
A. v(D)="0.4" mol / (L·s) B. v(C)="0.5" mol / (L·s)
C. v(B)="0.6" mol / (L·s) D. v(A)="0.15" mol / (L·s)
难度: 中等查看答案及解析
-
醋酸溶液中存在电离平衡 CH3COOH
CH3COO- + H+,下列叙述不正确的是
A. 升高温度,平衡正向移动,醋酸的电离常数Ka增大
B. 0.10 mol/L的CH3COOH 溶液加水稀释,溶液中c(OH-)增大
C. CH3COOH溶液加少量的CH3COONa固体,平衡逆向移动
D. 室温下,欲使0.1 mol/L醋酸溶液的pH、电离度α都减小,可加入少量水
难度: 简单查看答案及解析
-
下列各组离子,在指定环境中一定能大量共存的是
A. 在含有0.1 mol/L Ca2+的溶液中:Na+、K+、ClO-、Cl-
B. 在pH为7的溶液中:Ag+、Fe3+、SO42-、Cl-
C. 在澄清透明的无色溶液中:Al3+、Cu2+、HCO3- 、NO3-
D. c(OH-)=1×10-13mol/L的溶液中:K+、SO42-、Cl-、HCO3-
难度: 中等查看答案及解析
-
HA为一元弱酸,在0.1 mol/L的NaA 溶液中,离子浓度关系正确的是
A. c(Na+) > c(A-) > c(H+) > c(OH-) B. c(Na+) > c(OH-) > c(A-) > c(H+)
C. c(Na+) + c(OH-) = c(A-) + c(H+) D. c(Na+) + c(H+) = c(A-) + c(OH-)
难度: 中等查看答案及解析
-
已知:常温下浓度均为0.1 mol/L的下列溶液的pH如表:
溶质
NaF
Na2CO3
NaClO
NaHCO3
pH
7.5
11.6
9.7
8.3
下列有关说法正确的是
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B. 等体积等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N前<N后
C. 若将CO2通入0. 1mol/LNa2CO3溶液至溶液中性,则溶液中2c(CO32-)+c(HCO3-)=0.1mol/L
D. 向Na2CO3溶液中通入少量的HF气体,化学反应方程式为:Na2CO3+2HF=CO2+H2O+2NaF
难度: 简单查看答案及解析
-
①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,不正确的是( )
A. 水电离的c(H+):①=②=③=④
B. 将②、③溶液混合后,pH=7,消耗溶液的体积:②>③
C. 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D. 向溶液中加入100 mL水后,溶液的pH:③>④>②>①
难度: 中等查看答案及解析
-
在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)⇌xC(g),有图 I(T表示温度,P 表示压强,C%表示 C 的体积分数)所示的反应曲线,试判断对图 II 的说法中正确的是
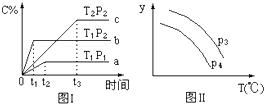
A. 若 P3>P4,则 y 轴表示 B 的百分含量
B. 若 P3>P4,则 y 轴表示混合气体的平均摩尔质量
C. 若 P3<P4,则 y 轴表示 B 的体积分数
D. 若 P3<P4,则 y 轴表示混合气体的密度
难度: 困难查看答案及解析