-
相同温度下,根据三种酸的电离常数,下列判断正确的是( )
酸
HX
HY
HZ
电离常数K
9×10-7
9×10-6
1×10-2
A. 三种酸的强弱关系:HX>HY>HZ
B. 反应HZ+Y-===HY+Z-能够发生
C. 相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D. 相同温度下,1 mol·L-1 HX溶液的电离常数大于0.1 mol·L-1 HX
难度: 简单查看答案及解析
-
海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O===2HBr+H2SO4,下列说法正确的是( )。
A. Br2在反应中表现氧化性 B. SO2在反应中被还原
C. Br2在反应中失去电子 D. 1 mol氧化剂在反应中得到1 mol电子
难度: 中等查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是:
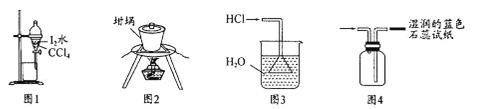
A. 用图1所示装置分离有机层和水层
B. 用图2所示装置从食盐水中提取NaCl
C. 用图3所示装置用水来吸收HCl
D. 用图4所示装置收集并检验氨气
难度: 简单查看答案及解析
-
将下列各组物质发生反应生成的气体分别通入FeCl2溶液,不能与FeCl2发生反应的是
A. CaO和浓氨水 B. 二氧化锰和浓盐酸共热
C. Na2O2和CO2 D. 铜片和浓硫酸共热
难度: 中等查看答案及解析
-
已知(1)H2(g) +1/2O2(g) === H2O(g) △H1= a kJ/mol
(2)2H2(g) + O2(g) === 2H2O(g) △H2= b kJ/mol
(3)H2(g) + 1/2O2(g) === H2O(l) △H3= c kJ/mol
(4)2H2(g) + O2(g) === 2H2O(l) △H4= d kJ/mol 下列关系式中正确的是
A. a < c < 0 B. b > d > 0 C. 2a = b < 0 D. 2c = d > 0
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 为比较氯和硫元素非金属性强弱,可测同条件下同浓度的NaCl溶液和Na2S溶液的pH
B. 用盐酸滴定氨水可选用甲基橙作指示剂
C. 在某溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液中一定含SO42 –
D. SO2和Cl2都能使品红溶液褪色,其原理相同
难度: 中等查看答案及解析
-
下列各组物质中,X 是主体物质,Y 是少量杂质,Z 是为除去杂质所要加入的试剂,其中所加试剂 正确的一组是( )
选项
A
B
C
D
X
FeCl2 溶液
FeCl3 溶液
Fe
Na2SO4 溶液
Y
FeCl3
CuCl2
Al
Na2CO3
Z
Cl2
Fe
NaOH 溶液
BaCl2 溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学在生产和日常生活中有着重要应用。下列说法不正确的是
A. 施肥时,草木灰(有效成份K2CO3)不能与NH4Cl 混合使用
B. 将Al2(SO4)3 溶液加热、蒸干、灼烧,可得到固体Al2(SO4)3
C. 在服用胃舒平(主要成分有氢氧化铝)期间不能食用醋等酸性食品
D. 铁在潮湿的环境下生锈以及Mg与NH4Cl溶液反应生成H2都与盐类水解有关
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,其中部分元素在周期表中的位置如图所示。一个WX2分子中含有22个电子,Y的质子数是X、Z的核电荷数之和的—半。下列说法正确的是
W
X
Z
A. 非金属性:W < Z
B. 简单离子的半径:X2- < Y2+
C. 沸点:H2X < H2Z
D. WX2的电子式为:
难度: 中等查看答案及解析
-
一定条件下,某反应达到平衡,其平衡常数为 K=c(CO2)·c(NO)/c(NO2)·c(CO),恒容时升高温度,混合气体的颜色加深,下列说法不正确的是
A. 该反应的焓变为负值
B. 化学方程式为 NO2(g)+CO(g)⇌CO2(g)+NO(g)
C. 降温,正反应速率减小
D. 恒温时,增大压强颜色加深,平衡逆向移动
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A. 1mol Fe溶于过量稀硝酸,电子转移数为2NA
B. 标准状况下,2.24L CCl4含有分子的数目为0.1NA
C. 46g NO2和N2O4混合气体中含有原子总数为3NA
D. 2 mol SO2 和1 mol O2催化反应后分子总数为2NA
难度: 中等查看答案及解析
-
下列说法正确的是
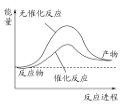
A. 上图可表示水分解过程中的能量变化
B. 若2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol
C. 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D. 已知Ⅰ:反应H2(g)+Cl2(g)===2HCl(g) ΔH=-a kJ/mol
Ⅱ:

且a、b、c均大于零,则断开1 mol H—Cl键所需的能量为(a+b+c)kJ/mol
难度: 中等查看答案及解析
-
下列实验操作及现象能够达成相应实验目的的是
实验目的
实验操作及现象
A
检验Na2SO3溶液是否变质
向Na2SO3溶液中加入Ba(NO3)2溶液,出现白色沉淀,再加入稀硝酸,沉淀不溶解
B
证明酸性条件下H2O2氧化性强于I2
向淀粉KI溶液中滴入3滴稀硫酸,未见溶液变蓝;再加入10%的H2O2溶液,溶液立即变蓝色
C
证明碳的非金属性强于硅
将浓盐酸滴入碳酸钠固体中,生成的气体通入盛有水玻璃的试管中,出现浑浊
D
证明SO2具有漂白性
将SO2通入酸性KMnO4 溶液中,溶液紫色褪去
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是
A. 将饱和FeCl3溶液滴入沸水中制胶体,离子方程式:Fe3++3H2O
Fe(OH)3 ↓+3H+
B. 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C. 自发进行的反应可能是熵增大且吸热的反应
D. 升温时,若某可逆反应化学平衡常数K值变小,则表明该反应的ΔH>0
难度: 中等查看答案及解析
-
现有室温下两种溶液,有关叙述正确的是
编号
①
②
pH
11
3
溶液
氢氧化钠溶液
醋酸溶液
A. 两种溶液中水的电离程度:①=②
B. 两种溶液的浓度:c(NaOH) > c(CH3COOH)
C. 两种溶液等体积混合后:c(CH3COO-) > c(Na+) >c(OH-) > c(H+)
D. 加水稀释相同倍数后:c(Na+) > c(CH3COO-)
难度: 中等查看答案及解析