-
下列物质溶于水,能使水的电离程度变大的是( )
A. HCl B. NaHSO4 C. CH3COOH D. Na2CO3
难度: 中等查看答案及解析
-
相同温度下,根据三种酸的电离常数,下列判断正确的是( )
酸
HX
HY
HZ
电离常数K
9×10-7
9×10-6
1×10-2
A. 三种酸的强弱关系:HX>HY>HZ
B. 反应HZ+Y-===HY+Z-能够发生
C. 相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D. 相同温度下,1 mol·L-1 HX溶液的电离常数大于0.1 mol·L-1 HX
难度: 简单查看答案及解析
-
相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是
A. pH相等的两溶液中:c(CH3COOˉ)=c(Clˉ)
B. 分别中和pH相等、体积相等的两溶液,所需NaOH的物质的量相同
C. 相同浓度的两溶液,分别与金属镁反应,反应速率相同
D. 相同浓度的两溶液,分别与NaOH固体反应后呈中性的溶液中(忽略溶液体积变化):c(CH3COOˉ)=c(Clˉ)
难度: 困难查看答案及解析
-
下列说法正确的是
A. 向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红 B. Al3+、NO3-、Cl-、CO32-、Na+可大量共存于pH=2的溶液中 C. 乙醇和乙酸都能溶于水,都是电解质 D. 分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
难度: 中等查看答案及解析
-
在溶液导电性实验装置里,分别注入20 mL 4 mol·L-1的醋酸和20 mL 4 mol·L-1的氨水,灯光明暗程度相似,如果把这两种溶液混合后再试验,则
A. 灯光明暗程度不变 B. 灯光变暗 C. 灯光变亮 D. 灯光明暗程度变化不明显
难度: 中等查看答案及解析
-
下列各组离子能在指定溶液中,大量共存的是
①无色溶液中:K+、Cl-、Na+、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2 -、NO3-、S2-、SO32-
③水电离的c(H+)=10-12mo1·L-1的溶液中:Cl-、HCO3-、 NO3-、NH4+
④加入Mg能放出H2的溶液中:Mg2+、 NH4+、 Cl-、K+、SO42-
⑤使石蕊试液变红的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-、S2-
A. ①②⑤ B. ①③⑥ C. ②④⑤ D. ①②④
难度: 中等查看答案及解析
-
室温下,下列事实不能说明NH3•H2O为弱电解质的是
A. 0.1 mol•L-1 NH3•H2O溶液的pH小于13
B. 0.1 mol•L-1 NH4Cl溶液的pH小于7
C. 向0.1 mol•L-1 NH3•H2O溶液中加入MgCl2溶液产生白色沉淀
D. 相同条件下,浓度均为0.1 mol•L-1的NaOH溶液和氨水,氨水的导电能力弱
难度: 中等查看答案及解析
-
下列叙述正确的是
A. CO2溶于水得到的溶液能导电,所以CO2是电解质
B. 稀CH3COOH溶液加水稀释,醋酸电离程度增大,溶液的pH减小
C. 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A为强酸
D. 室温下,对于0.10 mol·L-1的氨水,加水稀释后溶液中c(NH)·c(OH-)变小
难度: 中等查看答案及解析
-
等体积等pH的Ba(OH)2、NaOH和NH3·H2O三种溶液滴加等浓度的盐酸将它们恰好中和,用去酸体积分别为V1、V2、V3,三者的大小关系正确是
A. V1=V2= V3 B. V1=V2﹤V3 C. V1<V2 = V3 D. V1=V2﹥V3
难度: 中等查看答案及解析
-
在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 1L0.1mol·L-1(NH4)2Fe(SO4)2·6H2O的溶液中:c(NH4+)+c(Fe2+)+c(H+)=c(OH-)+c (SO42-)
B. 向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-)
C. 向0.10mol·L-1Na2CO3溶液中通入少量CO2的溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D. 0.1 mol·L-1NH4HS溶液中:c(NH4+)<c(HS-)+c(H2S)+c(S2-)
难度: 中等查看答案及解析
-
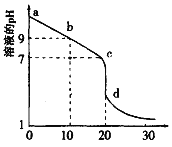
一定条件下,碳钢腐蚀与溶液pH的关系如下,下列说法不正确的是
pH
2
4
6
6.5
8
13.5
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe3O4
Fe2O3
FeO2-
A. 在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O
B. 在pH<4溶液中,碳钢主要发生析氢腐蚀
C. 在pH>6溶液中,碳钢主要发生吸氧腐蚀
D. 在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
难度: 简单查看答案及解析
-
下列溶液均处于25 ℃,有关叙述正确的是
A. 将醋酸溶液加水稀释1000倍,pH增大3
B. 在NaHCO3溶液中,c(Na+)=c(HCO3- )+c(H2CO3)
C. pH=13的NaOH溶液与pH=1的盐酸混合后,一定有c(H+)=c(OH-)
D. pH=8的Ba(OH)2溶液和pH=8的氨水中,由水电离的c(OH-)均为1×10-8mo1·L-1
难度: 中等查看答案及解析
-
下列说法正确的是
A. HS-的水解方程式为:HS-+ H2O
H3O++S2-
B. CH3COOH 溶液加水稀释后,溶液中
的值减小
C. 将pH =4的盐酸稀释后,溶液中所有离子的浓度均降低
D. 100℃时,pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1
难度: 中等查看答案及解析
-
下面提到的问题中,与盐的水解有关的是
①明矾和FeCl3可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③实验室配制AlCl3溶液时,应先把它溶解在盐酸中,而后加水稀释
④NH4Cl溶液可作焊接中的除锈剂
⑤实验室盛放Na2SiO3溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
⑦在NH4Cl或AlCl3溶液中加入金属镁会生成氢气
⑧草木灰与铵态氮肥不能混合施用
⑨加热蒸干AlCl3溶液得到Al(OH)3固体.
A. ①④⑦ B. ②⑤⑧ C. ③⑥⑨ D. 全部
难度: 中等查看答案及解析
-
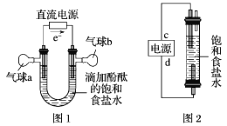
观察如图装置,下列说法正确的是
A. a、b接电流表,该装置为原电池
B. a、b接直流电源,该装置为电解池
C. a、b接直流电源,铁可能不易被腐蚀
D. a、b接电流表或接直流电源,铁都可能是负极
难度: 中等查看答案及解析
-
利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是
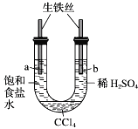
A. a管发生吸氧腐蚀,b管发生析氢腐蚀
B. 一段时间后,a管液面高于b管液面
C. a处溶液的pH增大,b处溶液的pH减小
D. a、b两处具有相同的电极反应式:Fe-2e-===Fe2+
难度: 中等查看答案及解析
-
常温下,pH=1的乙酸溶液和pH=13的NaOH溶液,下列叙述中正确的是
A. 两种溶液等体积混合后,溶液呈碱性
B. 乙酸溶液中c(CH3COOH)大于NaOH溶液中c(Na+)
C. 分别稀释10倍,两溶液的pH之和大于14
D. 若两溶液混合后pH=7,则有c(Na+)=c(CH3COO-)+c(CH3COOH)
难度: 困难查看答案及解析
-
t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是
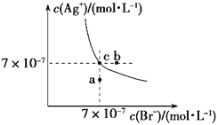
A. 在t ℃时,AgBr的Ksp为4.9×10-13
B. 通过蒸发,可使溶液由a点变到c点
C. 图中b点有AgBr沉淀析出
D. 在t ℃时,AgCl(s)+Br-(aq)
AgBr(s)+Cl-(aq)的平衡常数K≈816
难度: 中等查看答案及解析
-
将AgCl分别加入盛有:①5 mL水;②6 mL 0.5 mol·L-1 NaCl溶液;③10 mL 0.2 mol·L-1 CaCl2溶液;④50 mL 0.1 mol·L-1盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是
A. ④③②① B. ②③④① C. ①④③② D. ①③②④
难度: 中等查看答案及解析
-
下列说法正确的是
A. 已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大。
B. 25 ℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O
H++OH-逆向移动,c(H+)降低
C. 取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大
D. 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3- )
难度: 中等查看答案及解析
-
25℃时,在浓度都为1 mol·L-1的(NH4)2SO4、NH4H CO3、NH4HSO4、NH4Cl的四种溶液中,测得c(NH4+)分别为a、b、c、d(单位为mol·L-1)。下列判断正确的是
A. a=2b=2c=2d B. a>b>c> d C. a>c>d>b D. a>c>b>d
难度: 困难查看答案及解析
-
如图为以Pt为电极的氢氧燃料电池的工作原理示意图,稀H2SO4溶液为电解质溶液。下列有关说法不正确的是
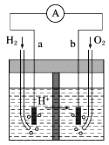
A. a极为负极,电子由a极经外电路流向b极
B. a极的电极反应式:H2-2e-===2H+
C. 电池工作一段时间后,装置中c(H2SO4)增大
D. 若将H2改为CH4,消耗等物质的量的CH4时,O2的用量增多
难度: 中等查看答案及解析
-
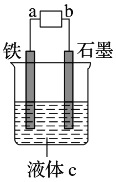
关于如图装置说法正确的是
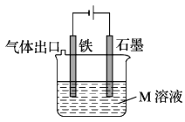
A. 装置中电子移动的途径是:负极→Fe→M溶液→石墨→正极
B. 若M为NaCl溶液,通电一段时间后,溶液中可能有NaClO
C. 若M为FeCl2溶液,可以实现石墨上镀铁
D. 若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
难度: 中等查看答案及解析
-
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。
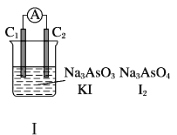
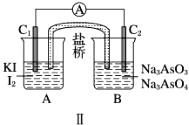
下列叙述中正确的是
A. 甲组操作时,电流表(A)指针发生偏转
B. 甲组操作时,溶液颜色变浅
C. 乙组操作时,C2作正极
D. 乙组操作时,C1上发生的电极反应为I2+2e-=2I-
难度: 中等查看答案及解析