-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) △H=xkJ·mol-1
已知:①碳的燃烧热△H1=akJ·mol-1
②S(s)+2K(s)==K2S(s) △H2=bkJ·mol-1
③2K(s)+N2(g)+3O2(g)==2KNO3(s) △H3=ckJ·mol-1 。则x为:
A. 3a+b-c B. c+3a-b C. a+b-c D. c+a-b
难度: 简单查看答案及解析
-
下列情况下,反应速率相同的是
A. 等体积0.1 mol/L HCl和0.1 mol/L H2SO4分别与等体积0.2 mol/L NaOH溶液反应
B. 等质量锌粒和锌粉分别与等体积1 mol/L HCl反应
C. 等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应
D. 等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质的石灰石反应
难度: 中等查看答案及解析
-
下列属于对环境不产生污染的二次能源的是
A. 煤炭 B. 核能 C. 风能 D. 氢能
难度: 简单查看答案及解析
-
已知4NH3+5O2═4NO+6H2O,反应速率分别用υ(NH3)、υ(O2) 、υ(NO) 、υ(H2O)表示,下列关系正确的是
A. 4/5v(O2)=v(NO) B. 5/6v(O2)=v(H2O)
C. 2/3v(NH3)=v(H2O) D. 4/5v(NH3)=v(O2)
难度: 中等查看答案及解析
-
反应A(g)+3B(g)⇌2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是
A. v(A)=0.15mol•L-1•min-1 B. v(B)=0.01mol•L-1•s-1
C. v(C)=0.40mol•L-1•min-1 D. v(D)=0.0075mol•L-1•s-1
难度: 中等查看答案及解析
-
下列热化学方程式及有关应用的叙述中,正确的是
A. 甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+ 2O2(g) ═ CO2(g) + 2H2O(g) △H = -890.3kJ•mol-1
B. 已知强酸与强碱在稀溶液里反应的中和热为57.3kJ•mol-1,则1/2H2SO4(aq)+1/2Ba(OH)2(aq)═1/2BaSO4(s)+H2O(l) △H = -57.3kJ•mol-1
C. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)
2NH3(g) △H = -38.6kJ•mol-1
D. 已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJ•mol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJ•mol-1,则O2比O3稳定
难度: 中等查看答案及解析
-
100mL 4mol/L 稀硫酸与2g锌粒反应,在一定温度下为了减缓反应的速率,但又不影响生成氢气的总量,可向反应物中加入( )
A. 硫酸钠固体 B. 硫酸铜固体 C. 硝酸钾溶液 D. 氯化钠溶液
难度: 中等查看答案及解析
-
下列说法或表示法正确的是
A. 等量的硫蒸气和硫固体分别完全燃烧,前者反应速率快,后者放出热量多
B. 由C(石墨,s)=C(金刚石,s) ΔH =+1.9 kJ·mol—1可知,石墨比金刚石稳定
C. 在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH1=-57.3 kJ· mol—1,若含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液的反应热为△H2,则△H1>△H2
D. 在101 kPa时,10g H2完全燃烧生成液态水,放出1429 kJ热量,氢气燃烧热的热化学方程式表示为2H2(g)+ O2(g)=2H2O(l) ΔH =-517.6 kJ· mol—1
难度: 中等查看答案及解析
-
下列说法正确的是
①活化分子间的碰撞一定能发生化学反应
②普通分子有时也能发生有效碰撞
③升高温度会加快反应速率,原因是增加了活化分子的有效碰撞次数
④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多
⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大
⑥化学反应实质是活化分子有合适取向时的有效碰撞
A. ①②⑤ B. ③④⑥ C. ③④⑤⑥ D. ②③④
难度: 中等查看答案及解析
-
对于反应4A+B=2C,下列说法不正确的是
A. 某温度下,化学反应速率无论是用A、B、C何种物质来表示,其化学反应速率的数值不一定相同,但意义相同
B. 在其他条件不变的情况下,降低温度,一般化学反应速率降低
C. 在其他条件不变的情况下,增大压强,单位体积内活化分子百分数一定增大,化学反应速率一定增大
D. 若增大或减少A物质的量,化学反应速率不一定会发生明显的变化
难度: 中等查看答案及解析
-
对反应A+B=AB来说,常温下按以下情况进行反应:
①20mL溶液中含A、B各0.01mol ②50mL溶液中含A、B各0.05mol
③0.1mol•L-1的A、B溶液各10mL ④0.3 mol•L-1的A、B溶液各50mL
四者反应速率大小关系是
A. ②>①>④>③ B. ④>③>②>① C. ①>②>④>③ D. ①>②>③>④
难度: 中等查看答案及解析
-
一定条件下,C(s)+CO2(g)
2CO (g) ΔH>0。下列有关叙述正确的是
A. 升高温度,v(正)增大,v(逆)减小
B. 增大压强,v(正)增大,v(逆)增大
C. 恒温恒压,再充入N2,反应速率不变
D. 增加炭的用量,v(正)增大
难度: 中等查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示,下列表述不正确的是
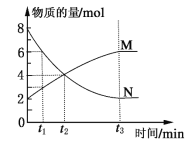
A. 反应的化学方程式为:3N
2M
B. t2时,正、逆反应速率不相等
C. t3时,正反应速率等于逆反应速率,达到平衡
D. t1时,N的浓度是M浓度的2倍
难度: 中等查看答案及解析
-
将2 mol X和2 mol Y充入2 L密闭容器中发生反应:X(g)+3Y(g)
2Z(g)+aQ(g)。2 min时达到平衡,生成0.8 mol Z,测得Q的浓度为0.4 mol·L-1,下列叙述错误的是( )
A.a的值为2 B.平衡时X的浓度为0.8 mol·L-1
C.Y的转化率为60% D.反应速率v(Y)=0.2 mol·L-1·min-1
难度: 中等查看答案及解析
-
可逆反应2NO2(g)═2NO(g)+O2(g)在体积不变的密闭容器中反应,现有以下几种说法:
①反应混合物中各物质的物质的量浓度相等
②单位时间内生成n mol O2 的同时生成2n mol NO2
③用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均摩尔质量不再改变的状态
其中表示反应达到平衡状态的是
A. ①③⑤ B. ②④⑥ C. ②③④⑥ D. ①②④⑤
难度: 中等查看答案及解析
-
如图是一定条件下N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
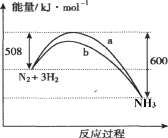
A. 该反应的热化学方程式为:N2+3H2
2NH3 △H=-92kJ·mol-1
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应的反应热将发生改变
D. 在相同温度的条件下,在体积相同I、II两个容器中分别通入1mol N2和3 mol H2,容器I体积恒定,容器II体积可变保持恒压,则反应过程中两容器内的反应速率v(I)<v(II)
难度: 中等查看答案及解析
-
已知Fe3+和I-在水溶液中的反应为2I-+2Fe3+
I2+2Fe2+。某温度下该反应的正反应速率和I-、Fe3+浓度的关系为v=kcm(I-)·cn(Fe3+)(k为常数)。
c(I-)/mol·L-1
c(Fe3+)/mol·L-1
v/mol·L-1·s-1
①
0.20
0.80
0.032k
②
0.60
0.40
0.144k
③
0.80
0.20
0.128k
由此推知,有关Fe3+、I-的浓度对反应速率影响的判断正确的是 ( )
A. Fe3+浓度对正反应速率的影响程度大于I-浓度的影响程度
B. Fe3+浓度对正反应速率的影响程度小于I-浓度的影响程度
C. Fe3+浓度对正反应速率的影响程度等于I-浓度的影响程度
D. 无法比较
难度: 中等查看答案及解析
-
研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如下图所示,下列说法错误的是
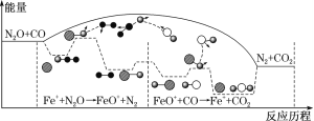
A. 反应总过程ΔH<0
B. Fe+使反应的活化能减小
C. FeO+也是该反应的催化剂
D. Fe++N2O
FeO++N2、FeO++CO
Fe++CO2两步反应均为放热反应
难度: 中等查看答案及解析
-
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H键所需的能量(kJ)是
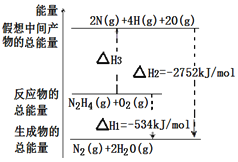
A. 194 B. 391 C. 516 D. 658
难度: 困难查看答案及解析
-
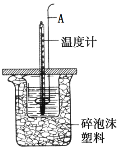
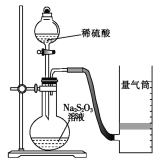
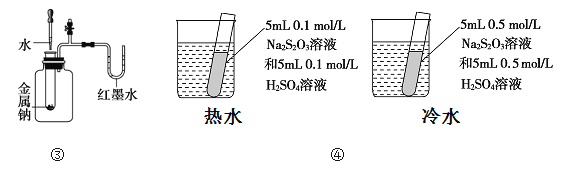
下列装置或操作能达到目的的是
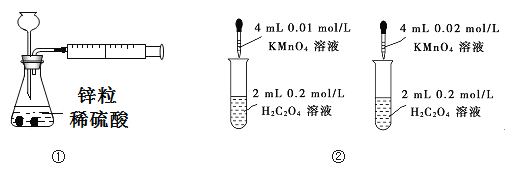
A. 装置①用于测定生成氢气的速率
B. 装置②依据褪色快慢比较浓度对反应速率的影响
C. 装置③依据U管两边液面的高低判断Na和水反应的热效应
D. 装置④依据出现浑浊的快慢比较温度对反应速率的影响
难度: 困难查看答案及解析