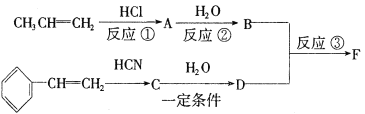
-
下列设备工作时,将化学能转化为热能的是( )
A.
 硅太阳能电池 B.
硅太阳能电池 B.  锂离子电池
锂离子电池C.
 太阳能集热器 D.
太阳能集热器 D.  燃气灶
燃气灶难度: 中等查看答案及解析
-
早在2007年3月21日,我国就公布了111号元素Rg的中文名称。该元素名称及所在周期是
A. 錀 第七周期 B. 铼 第六周期 C. 镭 第七周期 D. 氡 第六周期
难度: 简单查看答案及解析
-
16O和18O是不同的核素,下列说法正确的是(NA表示阿伏加德罗常数的值)
A. 16O2和18O2的物理性质、化学性质均相同 B. 16O2和18O2互为同位素
C. 36 g18O2含有16 mol电子 D. 4.48L18O2含有4NA个中子
难度: 简单查看答案及解析
-
原子序数大于4的主族元素Xm+、Yn-的离子核外电子层结构相同,则关于X、Y两元素的叙述正确的是
A. X的原子序数小于Y的原子序数 B. X、Y的核电荷数之差是(m-n)
C. X和Y处于同一周期 D. Y元素与X元素的族序数之差是8-(m+n)
难度: 简单查看答案及解析
-
已知W、X、Y、Z为短周期元素,原子序数依次增大.W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。下列说法一定正确的是
A. 含氧酸的酸性:W > Z
B. 简单离子半径:W > X
C. 气态氢化物的稳定性:W < Y
D. 若W与X原子序数差为5,则形成化合物的化学式为X3W2
难度: 简单查看答案及解析
-
下列关于化学反应速率的说法正确的是
A. 0.1 mol·L-1盐酸和0.1 mol·L-1硝酸与相同形状和大小的大理石反应的速率相同
B. 化学反应速率为0.8 mol·L-1·s-1,其含义是时间为1s时,某物质的浓度是0.8 mol·L-1
C. 2mol/L盐酸与锌反应时,加入4mol/L的氯化钠溶液,生成氢气的速率加快
D. 工业上合成氨是放热反应,升高温度,正反应速率减慢
难度: 简单查看答案及解析
-
下列反应中的能量变化与图示一致的是

A. 盐酸和NaOH溶液混合
B. CH4在空气中燃烧
C. 电解水得到H2和O2
D. Al与Fe2O3反应
难度: 简单查看答案及解析
-
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )

A. 微生物促进了反应中电子的转移
B. 正极反应中有CO2生成
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
难度: 中等查看答案及解析
-
某熔融碳酸盐燃料电池原理示意如图,下列有关该电池的说法正确的是
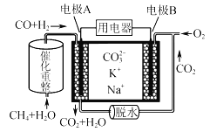
A. CH4+H2O
3H2+CO,1molH2O参加反应转移12×6.02×1023个电子
B. 电极A为正极
C. CH4在电极上被氧化
D. 电池工作时,CO32-向电极A移动
难度: 中等查看答案及解析
-
下列描述的化学反应状态,不一定是平衡状态的是
A. H2(g)+Br2(g)
2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
B. 2NO2(g)
N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
C. 3H2(g)+N2(g)
2NH3(g),反应体系中H2与N2的物质的量之比保持3∶1
D. CaCO3(s)
CO2(g)+CaO(s)恒温、恒容下,反应体系中气体的密度保持不变
难度: 中等查看答案及解析
-
下列说法正确的是
A. 乙烯、氯乙烯、聚氯乙烯均能使溴水褪色
B. 煤的气化就是把煤转化为可燃性气体的过程,该气体可用来合成液态烃及甲醇等含氧有机物
C. 等物质的量的乙烯和乙醇完全燃烧,乙烯消耗的氧气多
D. 间二甲苯只有一种结构,说明苯不是单双键交替的结构
难度: 简单查看答案及解析
-
化学与生活密切相关,下列有关说法错误的是( )
A.用灼烧的方法可以区分蚕丝和人造纤维
B.食用油反复加热会产生稠环芳香烃等有害物质
C.医用消毒酒精中乙醇的浓度为95%
D.加热能杀死流感病毒是因为蛋白质受热变性
难度: 简单查看答案及解析
-
己知
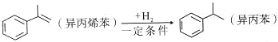 ,说法错误的是
,说法错误的是A. 该反应属于加成反应 B. 异丙苯是苯的同系物
C. 可用溴水鉴别异丙烯苯和异丙苯 D. 异丙苯的一氯代物共有6种
难度: 简单查看答案及解析
-
下列关于金属冶炼的说法正确的是
A. 炼铁高炉中所发生的反应都是放热的,故无需加热
B. 由于Al的活泼性强,故工业上采用电解熔融AlCl3的方法生产Al
C. 金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活泼性决定
D. 可以用钠加入氯化镁饱和溶液中制取镁
难度: 简单查看答案及解析
-
下列有关同分异构体数目的叙述中,正确的是
A. 苯乙烯和氢气完全加成的产物的一溴取代物有5种
B. 等物质的量的氯气与乙烷在光照条件下反应得到9种产物
C. 已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为6种
D. 甲苯苯环上的一个氢原子被含4个碳原子的烷基取代,所得产物有12种
难度: 困难查看答案及解析
-
0.5mol某羧酸与足量乙醇发生酯化反应,生成酯的质量比原羧酸的质量增加了28g,则原羧酸可能是
A. 乙二酸 B. 甲酸 C. 丙酸 D. 丁酸
难度: 简单查看答案及解析


 CH3CH3COOH
CH3CH3COOH