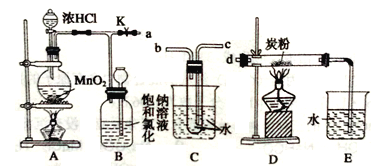
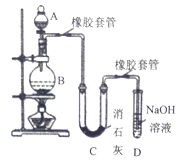
-
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
A. Na+、K+、OH-、Cl- B. Na+、Cu2+、SO42-、NO3-
C. Ba2+、HCO3-、NO3-、K+ D. Mg2+、Na+、SO42-、Cl-
难度: 简单查看答案及解析
-
据《本草纲目》记载:“生熟铜皆有青,即是铜之精华,大者即空绿,以次空青也。铜青则是铜器上绿色者,淘洗用之。”这里的”铜青”是指
A. CuO B. Cu2O C. Cu D. Cu2(OH)2CO3
难度: 中等查看答案及解析
-
在含有Fe3+、Fe2+、AL3+、NH4+的稀溶液中加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,反应完全后,离子数目几乎没有变化的是( )
A. Fe3+ B. Fe2+ C. AL3+ D. NH4+
难度: 简单查看答案及解析
-
下列有关叙述正确的是( )
A. 相同条件下,质量相等的CO和CO2它们所含的氧原子数目之比为11:7
B. 同体积、同密度的C2H4和CO,两种气体的分子数一定相等
C. 配制450mL0.1mol/L的NaOH溶液,用托盘天平称取NaOH固体1.8g
D. 1L0.45mol/LNaCl溶液中Cl-物质的量浓度比0.1L0.15mol/LAlCl3溶液大
难度: 中等查看答案及解析
-
在一个密闭容器中盛有11gX气体(X的摩尔质量为44g/mol)时,压强为1×104Pa。如果在相同温度下,把更多的气体X充入容器,使容器内压强增至5×104Pa,这时容器内气体X的分子数约为
A. 3.3×1025 B. 3.3×1024 C. 7.5×1023 D. 7.5×1022
难度: 中等查看答案及解析
-
某溶液中只含有Na+, Al3+,Cl-,SO42-四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
A. 1:2 B. 1:4 C. 3:4 D. 3:2
难度: 中等查看答案及解析
-
化学与生活密切相关,下列有关说法正确的是
A.PM2.5是指大气中直径接近2.5微米的颗粒物,入肺影响健康。它具有丁达尔现象
B.纯净的二氧化硅是制备光导纤维的原料
C.漂白粉既可做漂白棉麻纸张的漂白剂,又可做游泳池及环境的消毒剂和净水剂;
D.合金材料的组成元素一定全部是金属元素
难度: 简单查看答案及解析
-
下列的分离方法不正确的是( )。
A.用酒精萃取碘水中的碘
B.用蒸馏的方法将自来水制成蒸馏水
C.用过滤的方法除去食盐水中的泥沙
D.用淘洗的方法从沙里淘金
难度: 简单查看答案及解析
-
某学习小组讨论辨析以下说法: ①粗盐和酸雨都是混合物;②CO 和CO2都是酸性氧化物;③蔗糖、硫酸钡分别属于非电解质和电解质;④Na2O2 和CaO 都是碱性氧化物;⑤.盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦NaCl 和KC1可用焰色反应鉴别。上述说法正确的是
A. ①②③④ B. ①③⑦ C. ③⑤⑥⑦ D. ①②⑤⑥
难度: 中等查看答案及解析
-
某同学在实验室进行了如图所示的实验,下列说法中错误的是
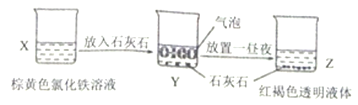
A. X、Z烧杯中分散质相同
B. 利用过滤的方法,可将Z中固体与液体分离
C. Y中反应的离子方程式为:3CaCO3+2Fe3++3H2O=2Fe(OH)3(胶体)+3CO2↑+3Ca2+
D. Z中的分散系能产生丁达尔效应
难度: 中等查看答案及解析
-
金刚砂(SiC)可由 SiO2 和碳在一定条件下反应制得,在反应方程式为 SiO2+3C
SiC+2CO↑中,下列有关制造金刚砂的说法中正确的是
A. 该反应中的氧化剂是 SiO2,还原剂为 C
B. 该反应说明了C 的还原性小于SiC
C. 该反应中转移的电子数为 12e-
D. 该反应中的还原产物是 SiC、氧化产物是 CO,其物质的量之比为 1:2
难度: 中等查看答案及解析
-
下列反应的离子方程式中,正确的是
A. 盐酸与饱和澄清石灰水反应: H++OH-=H2O
B. 向澄清石灰水中通入少量CO2:OH-+CO2=HCO3-
C. 钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
D. 稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑
难度: 中等查看答案及解析
-
NA代表阿伏伽德罗常数的值,下列说法正确的是
A. 2.8 g铁与0.05 mol Cl2 充分反应,转移0.15NA电子
B. 27 g Al与足量NaOH溶液反应生成33.6 L H2
C. 14 g由乙烯(C2H4)和丙烯(C3H6)组成的混合物中含有原子的数目为3NA
D. 300 mL 0.2 mol/L蔗糖溶液中所含分子数为0.06NA
难度: 困难查看答案及解析
-
浓度均为0.1 mol·L-1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是
A. BaCl2 NaOH NaHCO3 B. Na2CO3 MgCl2 H2SO4
C. AlCl3 NH3·H2O NaOH D. Ba(OH)2 CaCl2 Na2SO4
难度: 中等查看答案及解析
-
"NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl"是著名的"侯氏制碱法"的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是( )
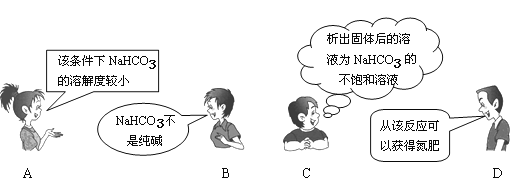
难度: 中等查看答案及解析
-
对实验Ⅰ~Ⅳ的实验操作现象判断正确的是
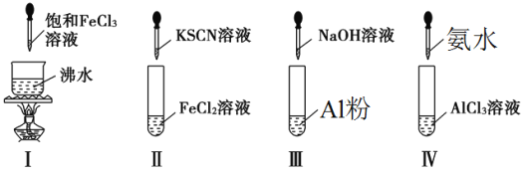
A. 实验Ⅰ:产生红褐色沉淀
B. 实验Ⅱ:溶液颜色变红
C. 实验Ⅲ:放出大量气体
D. 实验Ⅳ:先出现白色沉淀,后溶解
难度: 简单查看答案及解析
-
将过量的CO2分别通入:①CaCl2溶液;②Na2SiO3溶液;③NaAlO2溶液;④饱和Na2CO3溶液;⑤Ca(OH)2最终溶液中有白色沉淀析出或浑浊的是
A. ①②③④⑤ B. ②③④ C. ②④⑤ D. ①②④
难度: 中等查看答案及解析
-
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。关于该物质的说法正确的是
A. 该物质属于两性氢氧化物
B. 该物质是Al(OH)3和Na2CO3的混合物
C. 1molNaAl(OH)2CO3最多可消耗3molHF
D. 该药剂不适合于胃溃疡患者服用
难度: 困难查看答案及解析
-
碳酸氢钠受热容易分解为碳酸钠。现加热5.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.93g,则原混合物中碳酸钠的质量为
A. 2.48g B. 2.58g C. 4.16g D. 4.41g
难度: 中等查看答案及解析