-
分类法在化学学科的发展中起到了非常重要的作用,下列分类标准合理的是
A.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
B.根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应
C.根据水溶液是否能够导电,将物质分为电解质和非电解质
D.根据是否含氧元素,将物质分为氧化剂和还原剂
难度: 中等查看答案及解析
-
下列关于胶体的叙述中不正确的是
A.布朗运动是胶体微粒特有的运动方式,只用肉眼就可以把胶体和溶液、浊液区别开来
B.向Fe(OH)3胶体中加入少量H2SO4溶液,会生成红褐色沉淀
C.丁达尔效应是胶体的特性
D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列说法正确的是
A.1 mol氦气中有2NA个氦原子
B.14 g氮气中含NA个氮原子
C.2 L 0.3 mol·L-1Na2SO4溶液中含0.6NA个Na+
D.18 g水中所含的电子数为8NA
难度: 中等查看答案及解析
-
aLAl2(SO4)3溶液中含有Al3+为b mol,则该溶液里SO42-的物质的量浓度为
A.3b/2a B.2b/3a C.2b/a D.3b/a
难度: 中等查看答案及解析
-
下列溶液中的Cl-浓度与50 mL 1 mol·L-1 MgCl2溶液中的Cl-浓度相等的是
A.150 mL 1 mol·L-1 NaCl溶液 B.75 mL 2 mol·L-1 CaCl2溶液
C.150 mL 2 mol·L-1 KCl溶液 D.75 mL 1 mol·L-1 AlCl3溶液
难度: 中等查看答案及解析
-
将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为b g·cm-3,则该盐酸的物质的量浓度是 mol·L-1
A.
B.
C.
mol·L-1
D.
难度: 中等查看答案及解析
-
下列实验操作中正确的是
A.配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒2~3次,并将洗涤液一并倒入烧杯中稀释
B.玻璃导管蘸水后,边旋转边向橡皮管中插入
C.用胶头滴管向试管中加入液体时,为防止滴在试管外面,应将滴管尖嘴处伸入试管口中
D.称量氢氧化钠固体的质量时,将称量物放在纸片上,并置于托盘天平的左盘,砝码放在托盘天平的右盘。
难度: 中等查看答案及解析
-
下列化合物中依次属于氧化物、碱、盐的一组是
A.Na2CO3、KOH、CaO B.CO、NaOH、KCl
C.H2O、H2SO4、NaCl D.CuO、Cu2(OH)2CO3、CaCO3
难度: 中等查看答案及解析
-
下列说法正确的是
A.液态HCl、固体NaCl均不导电,所以HCl、NaCl均不是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.蔗糖、酒精在水溶液里或熔融状态时均不导电,所以它们不是电解质
D.铜、石墨均导电,所以它们是电解质
难度: 中等查看答案及解析
-
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液,则灯泡由亮变暗至熄灭,后又逐渐变亮的是
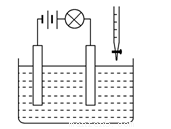
A.盐酸中逐滴加入食盐溶液
B.硫酸中逐滴加入NaOH溶液
C.硫酸中逐滴加入Ba(OH)2溶液
D.硫酸铜溶液中逐滴加入NaOH溶液
难度: 中等查看答案及解析
-
下列离子方程式中正确的是
A.碳酸钠溶液与石灰乳的反应:CO32-+Ca2+===CaCO3↓
B.硝酸银溶液与食盐水的反应:Ag++Cl-===AgCl↓
C.锌与盐酸的反应:Zn+2H++2Cl-===Zn2++2Cl-+H2↑
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O===Fe(OH)3↓+3H+
难度: 中等查看答案及解析
-
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.氢氧化钠与盐酸;氢氧化钠与碳酸
B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
C.Na2CO3溶液与盐酸溶液;CaCO3与盐酸
D.石灰石与硝酸反应;石灰石与盐酸
难度: 中等查看答案及解析
-
在含有碳酸根离子,且能使酚酞变红的无色溶液中,能大量共存的离子组是
A.Na+、SO32-、SO42-、K+
B.Na+、Cu2+、Br-、Ba2+
C.K+、MnO4-、NO3-、Na+
D.K+、Ca2+、SO32-、Cl-
难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是
A.在无色溶液中:NH4+、Fe2+、SO42-、CO32-
B.在含大量Ba2+的溶液中:NH4+、Na+、Cl-、OH-
C.在强碱溶液中:Na+、K+、Cl-、HSO3-
D.在pH =1的溶液中:K+、Na+、Cl-、CH3COO-
难度: 中等查看答案及解析
-
日常生活中,许多现象与氧化还原反应有关,下列现象与氧化还原反应无关的是
A.铜质奖章上出现铜绿[Cu2(OH)2CO3]
B.充有H2的“喜羊羊”娃娃遇明火发生爆炸
C.大理石雕像被酸雨腐蚀毁坏
D.轮船底部生锈
难度: 中等查看答案及解析
-
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是
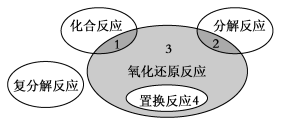
A.4Fe(OH)2+O2+2H2O===4Fe(OH)3
B.2NaHCO3
Na2CO3+H2O+CO2↑
C.4NH3+5O2
4NO+6H2O
D.Zn+H2SO4===ZnSO4+H2↑
难度: 中等查看答案及解析
-
高铁酸钾(KFeO4)是一种新型、高效、多功能水处理剂。下列反应可制取KFeO4:2Fe(OH)3+3Cl2+10KOH
2KFeO4+6KCl+8H2O,对于该反应下列说法正确的是
A.该反应是置换反应 B.钾元素化合价降低
C.Fe(OH)3发生还原反应 D.Cl2是氧化剂
难度: 中等查看答案及解析
-
下面有关氧化还原反应的叙述正确的是
A.有单质参加或生成的反应不一定是氧化还原反应
B.肯定有一种元素被氧化,另一种元素被还原
C.非金属单质在反应中只作氧化剂
D.某元素从化合态变为游离态时,该元素一定被还原
难度: 中等查看答案及解析
-
下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是
A.SO3+H2O===H2SO4
B.3NO2+H2O===2HNO3+NO
C.2F2+2H2O===4HF+O2
D.2Na+2H2O===2NaOH+H2↑
难度: 中等查看答案及解析
-
下列变化过程,需要加入氧化剂的是
A.HCl→MgCl2 B.Na+→Na C.CO→CO2 D.Fe3+→Fe2+
难度: 中等查看答案及解析
-
反应4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2O,下列说法正确的是
A.HNO3是氧化剂,NO2是氧化产物
B.若2mol HNO3(浓)完全反应,则反应中共转移了NA个电子
C.还原剂与氧化剂的物质的量比是1 :4
D.氧化产物和还原产物的物质的量之比为2 :1
难度: 中等查看答案及解析
-
在反应3Cl2+6KOH(浓)
KClO3+5KCl+3H2O中,氧化剂与还原剂物质的量之比为
A.1:5 B.4:1 C.5:1 D.1:4
难度: 中等查看答案及解析
-
常温下,在溶液中可发生以下反应:
①2Fe2++Br2===2Fe3++2Br-;②2Br-+Cl2===Br2+2Cl-;③2Fe3++2I-===2Fe2++I2。
由此判断下列说法错误的是
A.I-和Cl2不能够发生氧化还原反应
B.反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化
C.氧化性强弱顺序为:Cl2>Br2>Fe3+>I2
D.还原性强弱顺序为:I->Fe2+>Br->Cl-
难度: 中等查看答案及解析
-
已知:①5Cl2+I2+6H2O===2HIO3+10HCl
②ClO3-+5Cl-+6H+===3Cl2↑+3H2O
下列按物质氧化性顺序由强到弱排列正确的是
A.Cl2>ClO3->IO3- B.ClO3->Cl2>IO3-
C.ClO3->IO3->Cl2 D.Cl2>ClO3->IO3-
难度: 中等查看答案及解析
-
某溶液中只含有K+、Fe3+、NO3-,已知K+、Fe3+的个数分别为3a和a,则溶液中K+与NO的个数比为
A.1:2 B.1:4 C.3:4 D.3:2
难度: 简单查看答案及解析
-
亚硝酸盐中毒,又名乌鸦病、紫绀病、肠源性青紫病。亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象。美蓝是亚硝酸盐中毒的有效解毒剂。下列说法中,不正确的是
A.在中毒过程中血红蛋白被氧化
B.中毒时亚硝酸盐发生氧化反应
C.药品美蓝应具有还原性
D.解毒时血红蛋白被还原
难度: 简单查看答案及解析
-
下列变化过程属于氧化反应的是
A.HCl→H2 B.Mg→Mg2+ C.Cl-→AgCl D.CuO→Cu
难度: 简单查看答案及解析
-
下列反应既是氧化还原反应又是离子反应的是
A.钠在氯气中燃烧 B.二氧化碳通入澄清的石灰水中
C.氯化钠溶液中滴加硝酸银溶液 D.锌粒放入稀硫酸中
难度: 简单查看答案及解析
-
24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
A.+2价 B.+3价 C.+4价 D.+5价
难度: 简单查看答案及解析
-
锌与很稀的硝酸反应4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为
A.2.5 mol B.1 mol C.0.5 mol D.0.25 mol
难度: 中等查看答案及解析