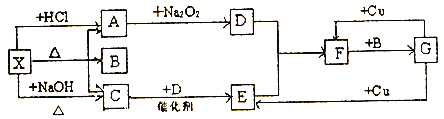
-
对下列实验事故或废弃药品的处理方法正确的是
A. 当有大量氯气泄漏时,人应沿顺风方向疏散
B. 金属钠意外着火时,应用干燥的沙土盖灭
C. 当少量浓硫酸沾在皮肤上,应立即用氢氧化钠溶液冲洗
D. 酒精失火用水浇灭
难度: 简单查看答案及解析
-
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
A. 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放人生石灰或硅胶
B. CO、NO、NO2都是大气污染气体
C. 国庆期间燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
D. 青铜是我国使用最早合金材料,目前世界上使用量最大合金材料是钢铁
难度: 简单查看答案及解析
-
下列叙述不正确的是
A.液态HCl不导电,但HCl属于电解质
B.NaHSO4溶于水电离出Na+、H+ 和SO42-,所以NaHSO4属于酸
C.氢氧化铁胶体和食盐水都属于混合物
D.Al(OH)3可用作胃酸中和剂,不会对胃壁产生强烈刺激
难度: 简单查看答案及解析
-
对于下列事实的解释不正确的是
A. 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
B. 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
D. 氨气可以完成喷泉实验,说明氨气极易溶于水
难度: 简单查看答案及解析
-
亚硫酸钠(Na2SO3)在反应中既可作氧化剂,又可作还原剂。当它作氧化剂时,理论上可能被还原成的是
①H2SO4 ②S ③Na2S ④Na2SO4 ⑤H2SO3 ⑥Na2S2O3
A. ①④ B. ①②③ C. ①⑤⑥ D. ②③⑥
难度: 简单查看答案及解析
-
已知阿伏加德罗常数为NA,下列说法正确的是
A. 2mol水中含有NA个H2O分子
B. 1g氢气含有NA个H2分子
C. 22.4L 氧气中含有NA个氧分子
D. 1mol铁与过量稀盐酸反应生成NA个H2分子
难度: 中等查看答案及解析
-
用如图表示的一些物质或概念间的从属关系中,正确的是
X
Y
Z
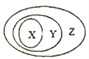
A
非金属单质
非电解质
纯净物
B
置换反应
氧化还原反应
离子反应
C
胶体
分散系
混合物
D
酸性氧化物
非金属氧化物
氧化物
A. A B. B C. C D. D.
难度: 中等查看答案及解析
-
抗震救灾中要用大量漂白粉和漂白液杀菌消毒。下列说法中正确的是
A. 漂白粉是纯净物,漂白液是混合物
B. 漂白粉的有效成分是Ca(ClO)2
C. 漂白液的有效成分是Na2O2
D. 工业上将氯气通入澄清石灰水制取漂白粉
难度: 简单查看答案及解析
-
下列对实验现象的描述与实际事实不一致的是
A. 将红热的铜丝伸入到盛有氯气的集气瓶中,产生蓝绿色的烟
B. 向pH 试纸上滴加氯水,先变红后变白
C. 向含少量Br2的CCl4中加NaOH 溶液,充分振荡,上下两层均为无色
D. 往氯水中加入NaHCO3固体,有气体产生
难度: 中等查看答案及解析
-
下列反应能用离子方程式OH-+HCO3-= CO32- +H2O 表示的是
A. NaOH+NaHCO3=Na2CO3+H2O
B. Ca(OH)2+Ca( HCO3)2=2CaCO3↓+2H2O
C. 2NaOH+NH4HCO3= NH3·H2O+Na2CO3+H2O
D. NaOH+Ca(HCO3)2= CaCO3↓+H2O+NaHCO3
难度: 中等查看答案及解析
-
某学生要提纯混有泥沙的食盐,他设计的主要操作有:溶解、过滤、蒸发。在这些操作中都需要使用的仪器是
A. 烧杯 B. 漏斗 C. 玻璃棒 D. 酒精灯
难度: 中等查看答案及解析
-
已知有如下反应:
①2BrO3-+Cl2→Br2+2 C1O3- ②C1O3-+5Cl-+6H+→3Cl2+3H2O
③2FeCl3+2KI→2FeCl2+2KCl+I2 ④2FeCl2+Cl2→2FeCl3
下列叙述正确的是
A. 氧化能力: C1O3->BrO3->Cl2>Fe3+>I2
B. 还原能力Fe2+>I->Cl-
C. 反应C1O3-+Br- →-Cl-+BrO3-能顺利进行
D. 氧化能力:BrO3- >ClO3->Cl2>Fe3+>I2
难度: 中等查看答案及解析
-
将足量CO2通入NaOH和NaAlO2的混合液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是 ( )
A.
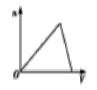 B.
B. 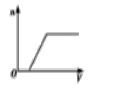 C.
C.  D.
D. 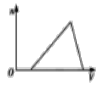
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. Cu溶于稀HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
B. 氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
C. AlCl3溶液中加入足量的氨水:Al3++4OH-=AlO2-+2H2O
D. FeCl3溶液与Cu反应:2Fe3++Cu=2Fe2++Cu2+
难度: 中等查看答案及解析
-
在无色透明的强酸性溶液中,下列离子组能大量共存的是( )
A. Na+、K+、OH-、Cl- B. Na+、Cu2+、SO42-、NO3-
C. Mg2+、Na+、SO42-、Cl- D. Ba2+、HCO3-、NO3-、K+
难度: 中等查看答案及解析
-
下列实验装置及操作不能达到实验目的是
A.除去粗食盐水中的泥沙
B.配制100 mL
1.00 mol/L 硫酸溶液
C. 排空气法
收集氨气
D.用自来水制取蒸馏水


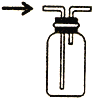
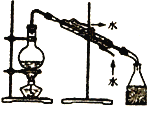
A. A B. B C. C D. D
难度: 中等查看答案及解析