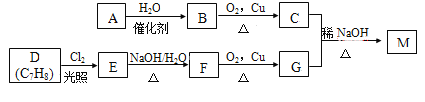
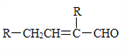-
如表实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
向装有石灰石的简易启普发生器中加入浓醋酸,将产生的气体通入苯酚钠溶液中
苯酚钠溶液产生浑浊
酸性:醋酸>碳酸>苯酚
B
将氯水加入到NaBr溶液中,所得混合溶液加入到KI和CCl4混合溶液中,振荡、静置
先无色NaBr溶液变黄色、后下层溶液显紫红色
非金属性:Cl>Br>I
C
向装有固体NaOH试管中加入浓氨水,产生的气体通入到AlCl3溶液中,
AlCl3溶液中出现白色浑浊
碱性:NaOH>NH3·H2O>Al(OH)3
D
向稀硫酸和硫化钠的混合溶液中滴入少量AgNO3溶液
出现黑色沉淀
说明Ksp(Ag2SO4)>Ksp(Ag2S)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
《本草纲目》中的“石碱”条目中写道:“采蒿蓼之属,晒干烧灰,以水淋汁,……浣衣发面,甚获利也”。这里的“石碱”是指( )
A. KOH B. KAl(SO4)2
C. KHCO3 D. K2CO3
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 用石墨作电极电解食盐水时,若阴极得到2NA个电子,则阳极一定产生22.4 LCl2(已折换算成标准状况下的体积)
B. 2 L 0.05 mol·L-1乙醇溶液中含有H原子数目为0.1NA
C. 4.0 g H
O与D2O的混合物中所含中子数为2NA
D. 常温下,1 mol的NaHCO3固体中HCO
的个数必定小于NA
难度: 简单查看答案及解析
-
下列关于化学反应的描述正确的是
A. NaHSO4溶液与Ba(OH)2溶液混合后显中性:Ba2++2OH-+2H++SO
===BaSO4↓+2H2O
B. 向Fe2(SO4)3溶液中通入足量Na2S溶液:2Fe3++S2-===2Fe2++S↓
C. 强碱溶液中,用次氯酸钠与Fe(OH)2反应是湿法制备高铁酸钠的最主要过程,可表示为:2ClO-+Fe(OH)2===FeO42—+2Cl-+2H+
D. 将少量二氧化碳通入次氯酸钠溶液中:CO2+H2O+2ClO-===CO32—+2HClO
难度: 中等查看答案及解析
-
已知:①CH3OH(g)+
O2(g)===CO2(g)+2H2O(g) ΔH1=-a kJ·mol-1
②CO(g)+
O2(g)===CO2(g) ΔH2=-b kJ·mol-1
③H2(g)+
O2(g)===H2O(g) ΔH3=-c kJ·mol-1
④H2(g)+
O2(g)===H2O(l) ΔH4=-d kJ·mol-1 下列叙述正确的是
A. 由上述热化学方程式可知ΔH3<ΔH4
B. H2的燃烧热为d kJ·mol-1
C. CH3OH(g)===CO(g)+2H2(g) ΔH=( a- b-2c)kJ·mol-1
D. 当CO和H2的物质的量之比为1∶2时,其完全燃烧生成CO2和H2O(l)时,放出Q kJ热量,则混合气中CO的物质的量为
mol
难度: 中等查看答案及解析
-
如图是利用一种微生物将废水中的有机物(如淀粉)和废气NO的化学能直接转化为电能,下列说法中一定正确的是
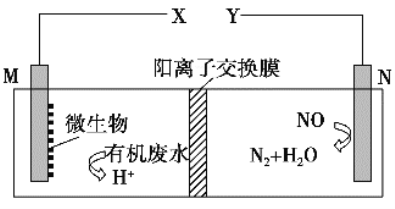
A. 质子透过阳离子交换膜由右向左移动
B. 与X相连接是用电器标有“+”的接线柱
C. M电极反应式:(C6H10O5)n+7nH2O-24ne-===6nCO2↑+24nH+
D. 当M电极微生物将废水中16.2 g淀粉转化掉时,N电极产生134.4 L N2(标况下)
难度: 中等查看答案及解析
-
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:
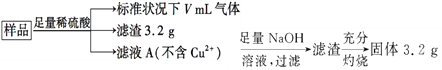
下列说法不正确的是A. 滤液A中的阳离子为Fe2+、H+
B. 样品中铁元素的质量为2.24 g
C. 样品中CuO的质量为4.0 g
D. V=448 mL
难度: 困难查看答案及解析
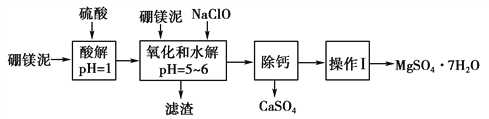
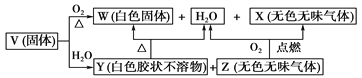

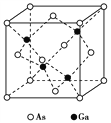
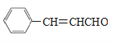 ):
):