-
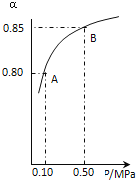
25℃和1.01×105Pa,反应2N2O5(g) = 4NO2(g) + O2(g);△H=" +" 56.76 kJ·mol-1能自发进行反应的原因是
A. 是吸热反应
B. 是放热反应
C. 是熵减少的反应
D. 熵增大效应大于能量效应
难度: 简单查看答案及解析
-
页岩气是从页岩层中开采出来的天然气,是一种重要的非常规天然气资源。我国的页岩气储量超过其他任何一个国家,可采储量有1275万亿立方英尺。这些储量足够中国使用300多年,有关页岩气的叙述错误的是
A. 页岩气属于一种新能源
B. 页岩气属于一次能源
C. 页岩气属于清洁能源
D. 页岩气属于不可再生能源
难度: 简单查看答案及解析
-
在水溶液中存在反应:Ag++Fe2+
Ag(s)+Fe3+ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( )
A. 升高温度 B. 加水稀释
C. 增大Fe2+的浓度 D. 常温下加压
难度: 中等查看答案及解析
-
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是

A. 改用25mL 0.50mol/L盐酸跟25mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同
B. 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌
C. 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热减少热量损失
D. 实验中应记录测量出反应过程中的最高温度
难度: 中等查看答案及解析
-
从下列实验事实所引出的相应结论正确的是
选项
实验事实
结论
A
其他条件相同,Na2S2O3与H2SO4反应时c(Na2S2O3)越大,析出S沉淀的时间越短
当其他条件不变时,增大反应物浓度,化学反应速率加快
B
在化学反应前后,催化剂的质量和化学性质都没有发生改变
催化剂一定不参与化学反应
C
物质的量浓度相同的盐酸和醋酸分别与等质量的、形状相同的锌粒反应
反应开始时速率相同
D
在容积可变的密闭容器中发生反应H2(g)+I2(g)
2HI(g),把容积缩小一倍
正反应速率加快,逆反应速率不变
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
对于可逆反应:2SO2(g)+O2(g)
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充入O2
难度: 中等查看答案及解析
-
不能用勒夏特列原理解释的是
A. 使用铁触媒,加快合成氨反应速率
B. 溴水中存在Br2+H2O
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
C. 合成氨工业采用20~50 MPa高压
D. 反应CO(g)+NO2(g)
CO2(g)+NO(g) ΔH<0,平衡后,升高温度体系颜色变深
难度: 中等查看答案及解析
-
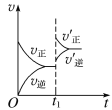
在一定条件下,可逆反应N2(g)+3H2(g)
2NH3(g) ΔH<0。达到平衡,当单独改变下列条件后,有关叙述错误的是
A. 加催化剂v正、v逆都发生变化,而且变化的倍数相等
B. 加压v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
C. 降温,v正、v逆都减小,且v正减小的倍数小于v逆减小的倍数
D. 加入氩气,v正、v逆都增大且v正增大的倍数大于v逆增大的倍数
难度: 中等查看答案及解析
-
研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如下图所示,下列说法错误的是

A. 反应总过程ΔH<0
B. Fe+使反应的活化能减小
C. FeO+也是该反应的催化剂
D. Fe++N2O
FeO++N2、FeO++CO
Fe++CO2两步反应均为放热反应
难度: 中等查看答案及解析
-
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
① C(s) + O2(g) = CO2(g) ;ΔH1 C(s) +
O2(g) = CO(g) ;ΔH2
② S(s) + O2(g) =SO2(g) ;ΔH3 S(g) + O2(g) = SO2(g) ;ΔH4
③ H2(g) +
O2(g) =H2O(l) ;ΔH5 2H2(g) + O2(g) = 2H2O(l) ;ΔH6
④ CaCO3(s) = CaO(s) + CO2(g) ;ΔH7 CaO(s) + H2O(l) = Ca(OH)2(s) ;ΔH8
A. ① B. ④ C. ②③④ D. ①②③
难度: 中等查看答案及解析
-
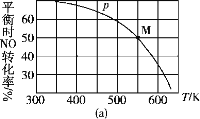
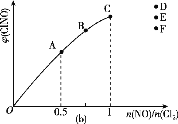
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的
为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应
:O3
O2+[O] ΔH>0 平衡常数为
;
反应
:[O]+O3
2O2 ΔH<0平衡常数为
;
总反应:2O3
3O2 ΔH<0平衡常数为K。
下列叙述正确的是( )
A. 降低温度,K减小
B.
C. 适当升温,可提高消毒效率
D. 压强增大,
减小
难度: 简单查看答案及解析
-
在一定温度下的恒容容器中,当下列物理量不再发生变化时,能说明下列反应:C(s)+CO2(g)
2CO(g)达到平衡状态的是:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的浓度之比等于化学计量数之比,⑦某种气体的百分含量
A. ①③④⑤⑦ B. ①②③④⑦
C. ②③④⑥⑦ D. ①②④⑤⑥
难度: 中等查看答案及解析
-
对反应A+B
AB来说,常温下按以下情况进行反应:①20 mL溶液中含A、B各0.01 mol ②50 mL溶液中含A、B各0.05 mol ③0.1 mol·L-1的A、B溶液各10 mL ④0.5 mol·L-1的A、B溶液各50 mL。四种情况下反应速率的大小关系是
A. ②>①>④>③ B. ④>③>②>①
C. ①>②>④>③ D. ①>②>③>④
难度: 中等查看答案及解析
-
已知反应:H2(g)+ 1/2O2(g)=H2O(g)△H1
1/2N2(g)+O2(g)=NO2(g)△H2 1/2 N2(g)+ 3/2H2(g)=NH3(g)△H3
则反应2NH3(g)+ 7/2O2(g)=2NO2(g)+3H2O(g)的△H为
A. 2△H1+2△H2﹣2△H3 B. △H1+△H2﹣△H3
C. 3△H1+2△H2+2△H3 D. 3△H1+2△H2﹣2△H3
难度: 中等查看答案及解析
-
一定条件下,对于可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A. c1∶c2=3∶1 B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等 D. c1的取值范围为0<c1<0.14 mol·L-1
难度: 中等查看答案及解析
-
工业生产硫酸的过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器中充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是
A. 2SO2(g)+O2(g)
2SO3(g) ΔH=−196.6 kJ·mol−1
B. 2SO2(g)+O2(g)
2SO3(g) ΔH=−98.3 kJ·mol−1
C. SO2(g)+1/2O2(g)
SO3(g) ΔH=+98.3 kJ·mol−1
D. SO2(g)+1/2O2(g)
SO3(g) ΔH=−49.2 kJ·mol−1
难度: 中等查看答案及解析
-
可逆反应2A(g)+B(g)
2C(g),根据下表中的数据判断下列图像错误的是
压强
A的转化率
温度
P1(MPa)
P2(MPa)
400℃
99.6%
99.7%
500℃
96.9%
97.8%
A.
 B.
B.  C.
C.  D.
D. 
难度: 中等查看答案及解析
-
已知:①2H2(g)+O2(g)
2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)
2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
③H+(aq)+OH-(aq)
H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A. H2(g)的燃烧热为142.9 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. 1/2H2SO4(aq)+1/2Ba(OH)2(aq)
1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)
CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
难度: 中等查看答案及解析
-
N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)
4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s
0
500
1 000
1 500
c(N2O5)/ mol·L-1
5.00
3.52
2.50
2.50
下列说法正确的是
A. 500 s内NO2的生成速率为2.96×10-3 mol·L-1·s-1
B. T1温度下该反应平衡时NO2的产率为25%
C. 达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)<5.00 mol·L-1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
难度: 中等查看答案及解析
-
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A. 在该条件下,反应前后的压强之比为6∶5.3
B. 若反应开始时容器体积为2 L,则v(SO3)=0.35 mol/(L·min)
C. 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D. 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
难度: 中等查看答案及解析