-
如果你家里的食用花生油不小心混入了大量的水,利用
你所学的知识,最简便的分离方法是
难度: 简单查看答案及解析
-
在标准状况下, 如果2.8升氧气含有n个氧分子,则阿伏加德罗常数为
A
B
C 16n D 8n
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.钠跟水反应:Na+H2O=Na++OH﹣+H2↑
B.向CuCl2溶液中加入氢氧化钠溶液:Cu2++2OH﹣= Cu(OH)2↓
C.盐酸与碳酸钙反应制备二氧化碳:CO32﹣+2H+=CO2↑+H2O
D.等物质的量硫酸氢钠溶液与氢氧化钡溶液反应:H++OH﹣=H2O
难度: 中等查看答案及解析
-
某溶液中加入铝片有氢气产生,则该溶液中一定能大量共存的离子组是
A.Cl- NO3- Ba2+ Fe3+ B.SO42- S2- Al3+ Mg2
+
C.Na+ K+ SO42- Cl- D.NH4+ Ba2+ Cl- HCO3-
难度: 中等查看答案及解析
-
氧化与还原在同一元素中进行的是
A.Cl2+2NaOH=NaCl+NaClO+H2O
B.Fe+CuSO4=FeSO4+Cu
C.2H2O
2H2↑+ O2↑
D.2KClO3
2KCl+ 3O2↑
难度: 中等查看答案及解析
-
下列关于金属Na的叙述中,正确的是
A.Na在常温下,与空气中的氧气不反应,所以Na不活泼
B.Na在空气中燃烧,发出黄色火焰,产物是Na2O
C.Na是银白色金属,硬度大、熔点高
D.Na应保存在煤油中K]
难度: 简单查看答案及解析
-
4.6g纯净金属钠在干燥空气中被氧化后,得到7.0g固体,由此可判断其氧化产物是
A.只有Na2O B.只有Na
2O2 C.Na2O2和Na2O D.无法确定
难度: 中等查看答案及解析
-
将一小块钠投入下列溶液中,既能产生气体又会出现沉淀的是
A.稀H2SO4 B.氢氧化钠溶液 C.NH4Cl溶液 D.氯化镁溶液
难度: 中等查看答案及解析
-
下列反应中,水既不是氧化剂又不是还原剂的反应是
A.2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
B.2Na + 2H2O =2NaOH + H2↑
C.2F2 + 2H2O = 4HF + O2
D.Na2O + 2H2O = 2NaOH
难度: 中等查看答案及解析
-
室温下,等质量的镁片和铝片分别与足量的稀硫酸反应,产生氢气的质量(m)与时间(t)的关系图正确的是
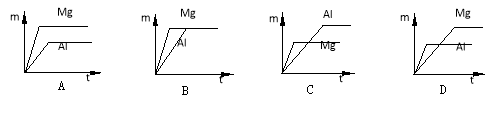
难度: 中等查看答案及解析
-
相同质量的Na、Mg、Al分别与足量稀盐
酸充分反应,生成H2的质量之比为
A.1︰2︰3 B.23︰24︰27 C.23︰12︰9 D.36︰69︰92
难度: 中等查看答案及解析
-
除去铁粉中少量铝粉,可选用的试剂是
A.稀HCl B.稀H2SO4 C.NaOH溶液 D.NaCl溶液
难度: 中等查看答案及解析
-
铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一,而加以控制。铝在下列使用场合须加以控制的是
①制铝锭 ②制易拉罐 ③制电线电缆 ④制牙膏皮 ⑤用明矾净水 ⑥制炊具 ⑦用明矾和苏打作食物膨化剂⑧用Al(OH)3制成药片治胃病 ⑨制防锈油漆
A.①②④⑤⑥⑦⑧ B.②⑤⑥⑦⑨ C.②④⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
难度: 中等查看答案及解析
-
铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和氢氧化钠的物质的量之比是
A.1:1 B.2:1 C.3:1 D.1:3
难度: 中等查看答案及解析
-
既能与酸(H+)反应,又能与碱(OH-)反应的是
①MgO ②Al ③NaHSO4 ④NaHCO3 ⑤CaCO3
A.①④ B.②③④ C.②④ D.②④③
难度: 中等查看答案及解析
-
甲、乙两烧杯中各盛放有100 mL3 mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=1∶2,则加入铝粉的质量为
A.5.4g B.3.6g C.2.7g D.1.8g
难度: 中等查看答案及解析
-
下列关于Na2O2的叙述正确的是
A.Na2O2是淡黄色固体,久置于空气中变成Na2O
B.Na2O2与水的反应中,Na2O2只作氧化剂
C.用0.1mol Na2O2与足量水反应转移的电子的物质的量为0.2mol
D.Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出
难度: 中等查看答案及解析
-
使5.6 L CO2气体迅速通过Na2O2固体后得到4.48 L(标准状况下)气体,这4.48 L气体的质量是
A.6.4 g B. 8.2 g C.6.2 g D.8.8 g
难度: 中等查看答案及解析
-
泡沫灭火器装的药液之一是NaHCO3饱和溶液,而不用更廉价的Na2CO3饱和溶液,其原因是
①质量相同的两种钠盐,NaHCO3与足量酸反应产生的CO2比
Na2CO3
多
②产生相同体积(同温、同压)的CO2,消耗的质量NaHCO3比Na2CO3少
③NaHCO3与酸反应比Na2CO3快得多
④NaHCO3比Na2CO3稳定,便于长期保存
A.只有①③ B.只有②
③ C.①②③ D.①②③④
难度: 中等查看答案及解析
-
为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.铝粉投入到NaOH溶液中: 2Al+2OH-=2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水: Al3++3OH-=Al(OH)3↓
C.碳酸氢钠溶液中滴加氢氧化钠溶液:HCO3-+OH-=CO2+H2O
D.过氧化钠与水的反应: 2Na2O2+2H2O=4Na++4OH-+O2↑
难度: 中等查看答案及解析
-
下列各组物质中,X是主体物质,Y是少量杂质,Z是要除去杂质而加入的试剂,其中正确的组别是
X
Y
Z
A.
FeCl2溶液
FeCl3
KSCN溶液
B.
A1粉
Fe粉
NaOH溶液
C.
Fe2(SO4)3溶液
FeSO4
C12
D.
FeCl2溶液
CuCl2
Fe粉
难度: 中等查看答案及解析
-
将盛有N2和NO2混合气体的试管倒立于水中,经过足够长的时间后,试管内气体的体积缩小为原来的一半,则原混合气体中N2和NO2的体积比是
A.1∶1 B.1∶2 C.1∶3 D.3∶1
难度: 中等查看答案及解析
-
取三张蓝色石蕊试纸湿润后贴在玻璃片上,然后按顺序分别滴加浓硝酸、98.3%的浓硫酸、新制氯水,三张试纸最终变成
A.白、红、白 B.红、黑、白 C.红、红、红 D.白、黑、白
难度: 中等查看答案及解析
-
将过量铁粉放入100 mL 2 mol/L的HNO3溶液中,假设还原产物只有NO且HNO3完全反应,则参加反应的Fe的质量为
A.2.8 g B.5.6 g C.4.2 g D.11.2 g
难度: 中等查看答案及解析


