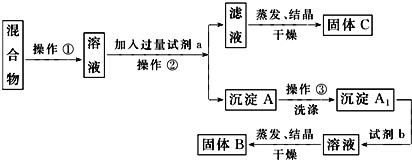
-
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤过滤正确的操作顺序是( )
A. ③②①⑤④ B. ①②③⑤④ C. ②③①④⑤ D. ③⑤②①④
难度: 中等查看答案及解析
-
化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列实验中所选用的仪器合理的是
①用50 mL量筒量取5.2 mL稀硫酸
②用托盘天平称量11.70g氯化钠晶体
③配制一定物质的量浓度的溶液时,定容时俯视刻度线会导致所配溶液浓度偏高
④用250 mL容量瓶配制250 mL 0.2 mol/L的NaOH溶液
A. ①② B. ②③ C. ①③ D. ③④
难度: 简单查看答案及解析
-
下列图标中警示腐蚀性物品的是( )
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
以下说法正确的是
A. 由一种元素组成的物质一定是纯净物
B. 氯化钠溶液能导电是因为氯化钠在电流作用下电离出钠离子,氯离子
C. 电解质与非电解质的分类标准是化合物在水溶液或熔化状态下能否导电
D. 碱性氧化物均是金属氧化物,酸性氧化物均是非金属氧化物
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 摩尔是国际单位制中的7个基本物理量之一
B. 硫酸的摩尔质量是98 g
C. 0.5molH 2 约含有3.01×1023 个氢原子
D. NA 个氧气分子与NA 个氢气分子的质量比为16∶1
难度: 中等查看答案及解析
-
在酸性的无色透明溶液中能够大量共存的是
A. NH4+、Fe3+、SO42-、Cl-
B. Mg2+、Ag+、CO32-、Cl-
C. K+、NH4+、Cl-、SO42-
D. K+、Na+、NO3-、HCO3-
难度: 简单查看答案及解析
-
下列各项操作中,发生“先产生沉淀,然后沉淀又溶解”现象的是:
①向石灰水中通入过量的CO2 ②向Fe(OH)3胶体中逐滴加入稀盐酸至过量 ③向Ba(OH)2溶液中逐滴加入过量的稀硫酸 ④向AgCl胶体中逐滴加入过量的稀硝酸.
A. ①② B. ①③ C. ①④ D. ②③
难度: 中等查看答案及解析
-
符合图中阴影部分的物质是( )

A. K2SO3 B. Na2SO4 C. K2SO4 D. KCl
难度: 简单查看答案及解析
-
下列溶液中Cl-浓度最大的是
A. 1000mL 2.5mol/L NaCl溶液 B. 200mL 2mol/L MgCl2溶液
C. 250mL 1mol/L AlCl3溶液 D. 300mL 5mol/L KClO3溶液
难度: 简单查看答案及解析
-
下列关于胶体的叙述中,正确的是
A. 丁达尔效应是分散系分类的本质特征,可区分溶液和胶体
B. 胶体能透过半透膜,但不能透过滤纸
C. Fe(OH)3胶体的电泳实验说明了胶体带有电荷
D. “江河入海口三角洲的形成”,在“伤口上撒盐”通常与胶体的聚沉有关
难度: 简单查看答案及解析
-
由氨气和氢气组成的混合气体的平均相对分子质量为12,则氨气和氢气的物质的量之比为
A. 1∶1 B. 1∶2 C. 2∶1 D. 3∶1
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 非标准状况下,1mol任何气体的体积不可能为22.4L
B. 标准状况下,11.2LH2O含有的分子数为0.5NA
C. 25℃,1.01×105Pa,16gCH4中含有的原子数为5NA
D. 92gNO2和N2O4的混合物含有的分子数为2NA
难度: 简单查看答案及解析
-
把0.05molNaOH固体分别加入到100mL下列液体中,溶液的导电能力变化最小的是( )
A. 自来水 B. 0.5 mol/L盐酸
C. 0.5 mol/L CH3COOH溶液 D. 0.5 mol/L KCl溶液
难度: 简单查看答案及解析
-
将标准状况下
LHCl溶于1L水中,得到的盐酸密度为bg/cm3,则该盐酸的物质的量浓度是
A.
mo1/L B.
mo1/L
C.
mo1/L D.
mo1/L
难度: 简单查看答案及解析
-
下列溶液中物质的量浓度为1 mol·L-1 的是
A. 将20 g NaOH 溶解在500mL 水中
B. 将22.4 L HCl 气体溶于水配成1 L 溶液
C. 从1 L 2 mol·L-1的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol·L-1
D. 配制250 mL CuSO4溶液,需62.5 g胆矾
难度: 简单查看答案及解析
-
相同温度和压强下,1 mol CO 和 1 mol CO2相比较,下列说法不正确的是
A.体积相同,但不一定是22.4L
B.分子数相同,但原子数不同
C.摩尔质量不同,氧原子个数相同
D.质子数不同,电子数也不同
难度: 中等查看答案及解析
-
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为
A. 5∶3 B. 5∶4 C. 1∶1 D. 3∶5
难度: 中等查看答案及解析
-
下列离子方程式书写不正确的是
A. 用NaHCO3治疗胃酸过多:HCO3-+H+=CO2↑+H2O
B. H2SO4溶液中投入锌粒:2H++Zn=H2↑+Zn2+
C. CaCO3溶于醋酸溶液:CaCO3+2H+=Ca2++H2O+CO2↑
D. 氯化铁和氢氧化钾溶液混合:Fe3++3OH-=Fe(OH)3↓
难度: 简单查看答案及解析
-
某溶液经分析,其中只含Na+、K+、Mg2+、Cl-、SO42-,已知其中Na+、K+、Mg2+、Cl-的浓度均为0.1 mol·L-1,则SO42- 的物质的量浓度为
A.0.1 mol·L-1 B.0.15 mol·L-1 C.0.2 mol·L-1 D.0.3 mol·L-1
难度: 中等查看答案及解析
-
下列反应能用H++OH-=H2O表示的是
A. NaOH溶液和CO2的反应
B. Ba(OH)2溶液和稀H2SO4的反应
C. NaHSO4溶液和KOH反应
D. 氨水和稀H2SO4的反应
难度: 简单查看答案及解析
-
下列各组微粒在指定溶液中一定能大量共存的是
A. 使酚酞变红的溶液:K+、H+、SO42-、CO32-
B. 纯碱溶液:K+、OH-、SO42-、NO3-
C. 澄清石灰水:Na+、Fe3+、CO2、Cl-
D. 稀硫酸溶液:Ba2+、Na+、HCO3-、NO3-
难度: 简单查看答案及解析
-
3molSO32-恰好将2molXO4-离子还原,SO32-被氧化为SO42-,则X元素在还原产物中的化合价是
A. +1 B. +2 C. +3 D. +4
难度: 简单查看答案及解析
-
已知98%的硫酸物质的量浓度为18.4 mol·L-1,则49%的硫酸物质的量浓度是( )
A.小于9.2 mol·L-1 B.等于9.2 mol·L-1
C.大于9.2 mol·L-1 D.不能确定
难度: 困难查看答案及解析
-
下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑤Cu ⑥H2O2 ⑦Fe2+ ⑧MnO42-。既具有氧化性又具有还原性的是
A. ①④⑤⑦ B. ③⑥⑦⑧ C. ④⑤⑥⑧ D. ①②③⑥
难度: 简单查看答案及解析
-
已知:2Fe2++Br2===2Fe3++2Br-,2Br-+Cl2===Br2+2Cl- , 2Fe3++2I-===2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中,不正确的是
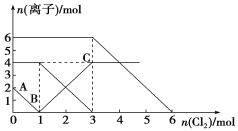
A. 还原性:I->Fe2+>Br-
B. 当通入2 molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
C. 原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3
D. 原混合溶液中FeBr2的物质的量为6 mol
难度: 困难查看答案及解析