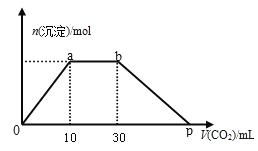
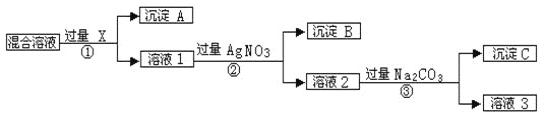
-
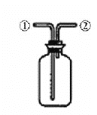
下列说法正确的是
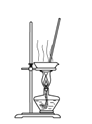
A. 如图所示装置蒸干Ca(HCO3)2饱和溶液制备Ca(HCO3)2 晶体
B. 如图所示装置制取少量纯净的CO2气体

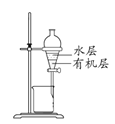
C. 如图所示装置分离苯萃取碘水后的有机层和水层
D. 如图所示装置可在广口瓶中先装满水,气体由②口入,收集CH4气体
难度: 简单查看答案及解析
-
现在三组物质的分离:①含有水份的植物油中除去水份②回收碘的CCl4溶液中的CCl4 ③含有极少量的青蒿素水溶液中加入适量乙酸乙酯(水溶性类似于汽油)。分离以上各混合液的正确方法依次是
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
难度: 简单查看答案及解析
-
下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量可忽略不计)。其中能表示等质量的氢气与氦气的是
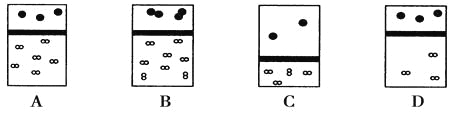
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 22.4 L N2O和CO2混合气体所含电子数目为22 NA
B. 将1 L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA
C. 1 L 0.1 mol/L醋酸溶液含有0.1 NA个H+
D. 28 g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
难度: 简单查看答案及解析
-
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,将粗盐溶于水,进行下列操作:①过滤;②加入适量的盐酸;③加入过量的氯化钡溶液;④加入过量的氢氧化钠溶液;⑤加入过量的碳酸钠溶液。正确的操作顺序是
A. ④③⑤①② B. ④⑤③①② C. ④⑤③②① D. ④③⑤②①
难度: 简单查看答案及解析
-
在标准状况下①13.44 L CH4②6.02×1023个HCl分子③27.2 g H2S ④0.4 mol NH3,下列对这四种气体的关系从大到小表达错误的是
A. 体积②>③>①>④ B. 质量②>③>④>①
C. 密度②>③>④>① D. 氢原子个数①>③>④>②
难度: 简单查看答案及解析
-
某MgCl2溶液的密度为1.6g·cm-3,其中镁离子的质量分数为10 %,300 mL该溶液中Cl-离子的物质的量约等于
A. 4.0 mol B. 3.0 mol C. 2.0 mol D. 1.0 mol
难度: 简单查看答案及解析
-
若以w1和w2分别表示浓度为amol/L和b mol/L氨水的质量分数,且知2a = b,则下列判断正确的是(氨水的密度比纯水的小)
A. 2 w1 = w2 B. 2 w2 <w1 C. w2 >2 w1 D. w1 <w2 <2 w1
难度: 简单查看答案及解析
-
下列物质含有的氧原子数最多的是
A. 80 g O3的气体 B. 0.5 mol CuSO4·5H2O晶体
C. 9.03×1023个CO2分子 D. 标准状况下 67.2 L NO2
难度: 简单查看答案及解析
-
有Ba(OH)2 (固体)、CuSO4·5H2O (固体)、CH3COOH (液态)这些物质归为一类,下列哪些物质还可以和它们归为一类
A. 医用酒精 B. 烧碱 C. Al(OH)3胶体 D. 碱石灰
难度: 简单查看答案及解析
-
下列物质的水溶液导电性最强的是
A. 10 mL 0.50 mol/LH2SO4溶液 B. 20 mL 0.50 mol/L KNO3溶液
C. 30 mL 0.50 mol/L氨水溶液 D. 40 mL 1.0 mol/L蔗糖溶液
难度: 简单查看答案及解析
-
关于胶体的性质与应用,相关说法错误的是
A. 静电除尘器除去空气或工厂废气中的飘尘是利用了胶粒的带电性
B. 由于胶粒之间有排斥作用,胶粒不易聚集成大的颗粒,这是胶体具有介稳性的主要原因
C. 纳米材料微粒直径一般从几纳米到几十纳米,因此纳米材料属于胶体
D. Al(OH)3胶体吸附水中的悬浮物属于物理过程
难度: 简单查看答案及解析
-
下列各组离子中,在无色透明的酸性溶液中能大量共存是
A. Na+、K+、Fe2+、Cl﹣ B. K+、CO32﹣、Cl﹣、SO42-
C. NO3﹣、Na+、HCO3﹣、Ca2+ D. Na+、NO3﹣、NH4+、SO42-
难度: 简单查看答案及解析
-
下列离子反应方程式错误的是
A. 向KHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全:H++SO42-+Ba2++OH﹣=H2O+BaSO4↓
B. 烧碱溶液与少量碳酸氢钙溶液混合: Ca2++HCO3﹣+OH﹣=CaCO3+H2O
C. 碳酸镁与稀硫酸: MgCO3+2H+=H2O+CO2↑+Mg2+
D. 醋酸与大理石: 2CH3COOH+CaCO3=Ca2++2CH3COO﹣+H2O+CO2↑
难度: 中等查看答案及解析
-
在b L Al2(SO4)3和(NH4)2SO4的混合溶液中加入a mol BaCl2,恰好使溶液中的SO42-﹣离子完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为
A. (2a-c)/b B. (2a-c)/2b C. (2a-c)/3b D. (2a-c)/6b
难度: 简单查看答案及解析
-
下列离子检验的方法错误的是
A. 某溶液中加CaCl2溶液生成白色沉淀,滴加稀盐酸沉淀溶解并产生无色无味的气体,说明原溶液中有CO32-
B. 某溶液中加入稀盐酸无明显现象,然后加入BaCl2溶液,有白色沉淀生成,说明原溶液中有SO42﹣
C. 某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,说明原溶液中有Ba2+
难度: 简单查看答案及解析
-
某NaOH样品中含有少量Na2CO3、NaHCO3和H2O,经分析测定,其中含NaOH83.4%(质量分数,下同), NaHCO3 8.8%,Na2CO3 6.4%,H2O 1.4%。将此样品若干克投入到49克21%的稀硫酸中,待反应完全后,需加入20克9.0%的NaOH溶液方能恰好中和。则蒸发中和后的溶液可得固体质量接近于
A. 25 B. 20 C. 15 D. 10
难度: 简单查看答案及解析
-
有Na2CO3、AgNO3、BaCl2、H2SO4及NH4NO3无标签浓溶液,为鉴别它们,取四只试管分别装入一种溶液,向上述四只试管中加入少许剩下的一种溶液,下列结论错误的是
A. 全部若没有什么现象变化时,则最后加的一定是NH4NO3溶液
B. 有三只试管出现沉淀时,则最后加入的一定是AgNO3溶液
C. 若只有两只试管出现沉淀时,则最后加入的可能是Na2CO3溶液
D. 一只试管出现气体,两只试管出现沉淀时,则最后加入的可能是H2SO4溶液
难度: 中等查看答案及解析