-
NA代表阿伏加德罗常数的值。下列说法正确的是
A. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
B. 25 ℃时,1L 0.1mol/L Na2S溶液中阴离子总数小于0.1NA
C. 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1 NA
D. 钠在空气中燃烧可生成多种氧化物。23g钠充分燃烧时转移电子数为NA
难度: 中等查看答案及解析
-
我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下:
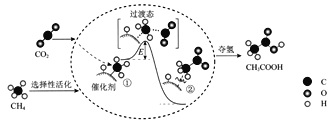
则下列说法错误的是
A. 生成CH3COOH总反应是化合反应
B. ①→②过程形成了C―C键
C. CH4→CH3COOH过程中,有C―H键发生断裂
D. ①→②吸收能量
难度: 中等查看答案及解析
-
CH4-CO2催化重整反应为:CH4(g)+ CO2(g)=2CO(g)+2H2(g)。已知:①C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1②C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1③C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1则该催化重整反应的ΔH等于
A. -580 kJ·mol−1 B. +247 kJ·mol−1 C. +208 kJ·mol−1 D. -430kJ·mol−1
难度: 中等查看答案及解析
-
下列说法正确的是
A. 将纯水加热至较高温度,Kw变大、pH变小、呈酸性
B. 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C. 向0.1 mol·L-1醋酸溶液中加入少量冰醋酸,溶液的pH减小,醋酸电离程度变大
D. 等体积、pH都为3的酸HA和HB分别与足量的Zn反应,HA放出的H2多,说明HA的酸性小于HB
难度: 中等查看答案及解析
-
H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应H2NCOONH4(s)
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①每生成34g NH3的同时消耗44g CO2 ②混合气体的平均相对分子质量不变 ③NH3的体积分数保持不变 ④混合气体的密度保持不变 ⑤c(NH3):c(CO2)=2:1
A. ①③⑤ B. ①③④ C. ②④ D. ①④
难度: 中等查看答案及解析
-
向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应:3A(g)
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是
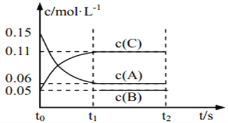
A. 若t1=15s, A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.09 mol·L-1·s-1
B. t0~t1阶段,此过程中容器放出a kJ热量,该反应的热化学方程式为:3A(g)
B(g)+2C(g) ΔH=-50a kJ·mol-1
C. 该容器的容积为2 L,B的起始的物质的量为0.03 mol
D. t1时该反应达到平衡且A 的转化率为60%
难度: 中等查看答案及解析
-
下列关于化学反应速率的说法正确的是
①有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子数目,从而使反应速率增大。
②其他条件不变,温度越高,化学反应速率越快。
③6mol·L﹣1·s﹣1的反应速率一定比3.5mol·L﹣1·s﹣1的反应速率大。
④升高温度能增大反应物分子中活化分子的百分数。
⑤恒温时,增大压强,化学反应速率一定加快。
⑥增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多。
A. ①②⑤ B. ②④ C. ②⑤ D. ③ ⑥
难度: 中等查看答案及解析
-
室温下,下列有关两种溶液的说法不正确的是
序号
①
②
pH
11
11
溶液
氨水
氢氧化钠溶液
A. ①②两溶液中水的电离程度相同
B. ①②两溶液中c(OH-)相等
C. 等体积的①②两溶液分别与0.01mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②
D. ①②两溶液分别加水稀释10倍,稀释后溶液的pH :①<②
难度: 中等查看答案及解析
-
可逆反应:L(s)+aG(g)
bR(g) ΔH达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.下列判断正确的是
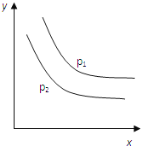
A. ΔH<0
B. 增加L的物质的量,可提高G的转化率
C. 升高温度,G的转化率减小
D. a<b
难度: 中等查看答案及解析
-
向一个绝热恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)
CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示,由图可得出的结论正确的是
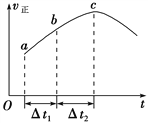
A. 反应物浓度:a点小于c点
B. 该反应的正反应为放热反应
C. c点达到平衡状态
D. Δt1=Δt2时,H2的产率:a~b段大于b~c段
难度: 困难查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)ΔH<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入6molSO2和3molO2,乙容器恒温恒容,充入6molSO3,丙容器恒温恒压,充入6molSO3,充分反应达到平衡,下列说法正确的是
A. 乙中SO3的体积分数大于丙
B. 转化率:α甲(SO2)+α乙(SO3)=1
C. 乙和丙中的SO2的生成速率相同
D. 甲和丙中反应的化学平衡常数相同
难度: 困难查看答案及解析
-
已知一定温度下,X(g)+2Y(g)
mZ(g);ΔH =-akJ/mol(a>0)现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达平衡状态时,放出热量ckJ,且2b < c,则下列各值关系正确的是
A. a = b B. 2a < c C. m > 3 D. m < 3
难度: 中等查看答案及解析
-
在容积为2L的密闭容器中发生反应xA(g)+yB(g)
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示200 ℃、100 ℃下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是

A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B. 若在图甲所示的平衡状态下再向体系中充入He,此时v正> v逆
C. 由图乙可知,反应xA(g)+yB(g)
zC(g)的ΔH<0,且a=1
D. 200℃时,向容器中充入2molA和1molB,达到平衡时A的体积分数小于0.5
难度: 中等查看答案及解析
-
一定温度下,在三个容积均为1.0L的恒容密闭容器中发生反应:CH3OH(g)+CO(g)
CH3COOH(g) ΔH<0。下列说法正确的是
容器编号
温度/K
物质的起始浓度/mol/L
物质的平衡浓度/mol/L
c(CH3OH)
c(CO)
c(CH3COOH)
c(CH3COOH)
I
600
1.0
1.0
0
0.80
II
600
0.40
0.40
0.80
III
575
0
0
1.0
A. 达平衡时,容器II中
比容器I中的大
B. 达平衡时,容器Ⅲ中的正反应速率比容器I中的大
C. 达平衡时,容器I与容器II中的总压强之比为5:6
D. 达平衡时,容器Ⅲ中c(CH3COOH)小于0.80mol/L
难度: 困难查看答案及解析
-
LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变化如图1所示,H3PO4溶液中H2PO4–的分布分数
随pH的变化如图2所示,
下列有关LiH2PO4溶液的叙述正确的是

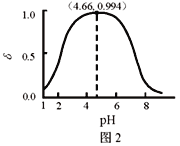
A. 含P元素的粒子有H2PO4–、HPO42–、PO43–
B. LiH2PO4溶液中存在2个平衡
C. 用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
D. 随c初始(H2PO4–)增大,溶液的pH明显变小
难度: 中等查看答案及解析
-
已知pOH=-lgc(OH-)。T℃时,往50mL0.1mol·L-1MOH溶液中滴加0.1mol·L-1盐酸,溶液pH、pOH随滴入盐酸体积的变化如下图所示,以下说法正确的是
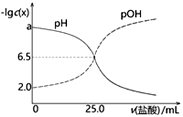
A. 盐酸与MOH溶液恰好中和时溶液pH=6.5
B. a=12
C. 盐酸滴定MOH实验中选择酚酞做指示剂比选甲基橙误差更小
D. T℃时,MOH的电离平衡常数Kb约为1.0×10-3
难度: 中等查看答案及解析
-
电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液滴定10.00 mL浓度均为0.100 mol·L-1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
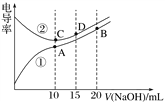
A. 曲线①代表滴定HCl溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A
D. D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
难度: 困难查看答案及解析