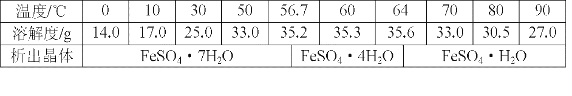
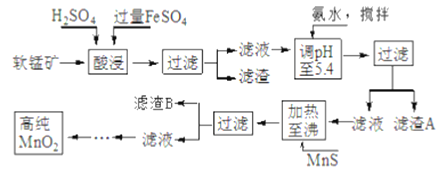
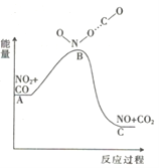
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,11.2 L水中含有的分子数是0.5NA
B. 常温常压下,17g氨气中所含原子数为NA
C. 1 mol OH- 中含有电子数为10NA
D. 1 mol/LBaCl2溶液中含有的氯离子数为2NA
难度: 简单查看答案及解析
-
“一带路(OneBelt AndOneRoad)”构建人类命运共同体,符合国际社会的根本利益,彰显著人类社会的共同理想和关好追求。下列贸易的商品中,其主要成分属于无机物的是( )
A. 捷克水晶 B. 埃及长绒棉 C. 乌克兰葵花籽油 D. 中国丝绸
难度: 中等查看答案及解析
-
下列有关实验的选项正确的是
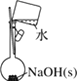
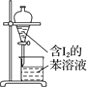
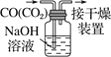
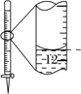
A.配制 0.10 mol·L-1NaOH溶液
B.苯萃取碘水中I2,分出水层后的操作
C.除去CO中的CO2
D.记录滴定终点读数为12.20mL
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
二羟甲戊酸是生物合成青蒿素的原料之一,其结构如图所示。下列关于二羟甲戊酸的说法正确的是
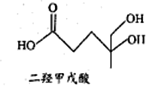
A. 分子式为C3H14O4
B. 能使酸性KMnO4溶液褪色
C. 能发生加成反应,不能发生取代反应
D. 1mol该有机物与足量金属钠反应产生22.4L H2
难度: 中等查看答案及解析
-
四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是( )
A. Z元素位于周期表的第三周期第VA族
B. X、W元素的最高价氧化物对应水化物的酸性:W强于X
C. Y元素的气态氢化物的热稳定性比Z的高
D. X与W形成共价化合物XW2, X的原子半径比Y小
难度: 中等查看答案及解析
-
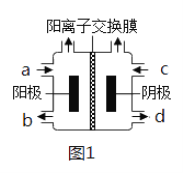
某化学课外活动小组拟用铅蓄电池进行电絮凝净水的实验探究,设计的实验装置如图所示,下列叙述正确的是( )
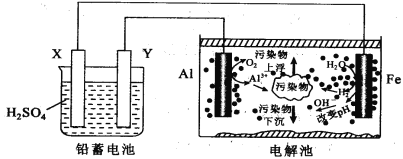
A. Y 的电极反应: Pb-2e- = Pb2+
B. 铅蓄电池工作时SO42-向 Y 极移动
C. 电解池的反应仅有2Al+6H2O
2Al(OH)3+3H2↑
D. 每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成
难度: 中等查看答案及解析
-
室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列正确的是
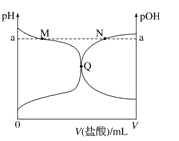
A. M 点所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 点所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 点盐酸与氨水恰好中和
D. M 点到Q点所示溶液中水的电离程度先变大后减小
难度: 困难查看答案及解析