-
化学与生产、生活、社会密切相关,下列有关说法正确的是( )
A.光导纤维在信息领域应用越来越广泛,其主要成分是硅单质
B.“地沟油”禁止食用,但可以用来制肥皂
C.明矾常用于水体杀菌消毒
D.中秋将至,为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列叙述正确的是( )
A.1molFe溶于过量稀硝酸,电子转移数为2NA
B.标准状况下,2.24LCCl4含有分子的数目为0.1NA
C.46gNO2和N2O4混合气体中含有原子总数为3NA
D.1L0.1mol/L的NaHCO3溶液中,HCO3-、CO32-离子数之和为0.1NA
难度: 困难查看答案及解析
-
在下列实验操作中,不能达到目的的是 ( )
A.向某溶液中加入氯水,然后加入KSCN溶液,检验该溶液中是否含有Fe2+
B.向偏铝酸钠溶液中通入过量CO2,制备氢氧化铝
C.用金属钠分别与水和乙醇反应,比较水和乙醇分子中羟基氢(-OH)的活泼性
D.用检验Na2CO3和Na2SO4水溶液酸碱性实验,证明碳和硫两元素非金属性的强弱.
难度: 简单查看答案及解析
-
下列各组物质中,满足表中图示物质在一定条件下能一步转化的组合有( )

A.②③ B.①③④ C.①④ D.①②③
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.将磁性氧化铁溶于盐酸:Fe3O4+8H+===2Fe2++Fe3++4H2O
B.FeCl3溶液腐蚀铜线路板:Fe3++Cu=Cu2++Fe2+
C.金属铝加入到NaOH溶液中:2Al+2OH-+2H2O===2AlO2-+3H2↑
D.铜与盐酸反应:Cu+2H+===Cu2++H2↑
难度: 中等查看答案及解析
-
对三联苯是一种有机合成的中间体。工业上合成对三联苯的化学方程式为

下列说法中不正确的是( )
A. 上述反应属于取代反应
B. 对三联苯的一氯取代物有3种
C. 1 mol对三联苯在足量的氧气中完全燃烧消耗21.5 mol O2
D. 对三联苯分子中至少有16个原子共平面
难度: 中等查看答案及解析
-
向100mL 0.1mol/L AlCl3 溶液中,加入c mol/L NaOH 溶液100mL后,再滴加1mol/L 盐酸,滴加盐酸的体积与生成沉淀的质量关系如图所示,则加入的NaOH溶液的浓度为( )
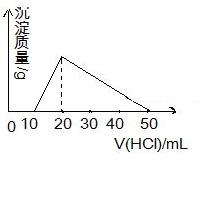
A.0.25mol/L B.2mol/L C.1mol/L D.0.5 mol/L
难度: 困难查看答案及解析



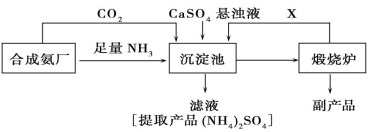
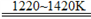 Ti+2MgCl2
Ti+2MgCl2
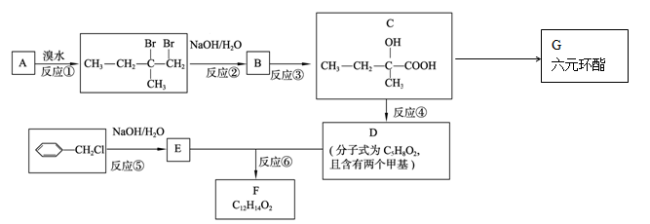 试回答下列问题:
试回答下列问题: