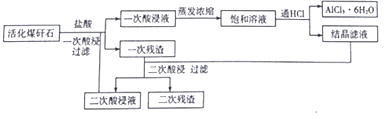
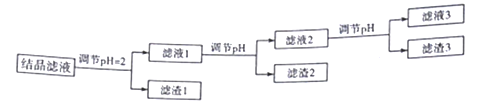
-
《本草纲目》记载了民间酿酒的工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……”在实验室中模拟上述过程,用到的仪器是
A. 蒸馏烧瓶 B. 蒸发皿 C. 球形冷凝管 D. 分液漏斗
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法错误的是
A. 7g CnH2n中含有NA个碳氢共价键
B. 标准状况下,22.4 L CHCl3中含有3NA个氯原子
C. 含0.3 mol NH4NO3与a mol NH3·H2O的中性溶液中含0.3NA个NH4+
D. 1mol Na与O2反应生成Na2O和Na2O2的混合物的过程中失去NA个电子
难度: 中等查看答案及解析
-
a、b、c、d、e为原子序数依次增大的5种短周期主族元素。常温下,a、d最高价含氧酸的浓溶液均可盛放在由金属元素c 的单质制成的的容器中,a的气态氢化物遇到e的单质会产生白烟,负一价b 离子的电子数等于e、a 的质子数之差。下列叙述正确的是
A. 简单离子半径:c>a
B. 最高价氧化物对应水化物的酸性:d>e
C. d2e2分子中各原子最外层都达到了8 电子结构
D. b与c形成的化合物是共价化合物
难度: 中等查看答案及解析
-
已知
 (a)、
(a)、 (b)的分子式均为C8H8,下列说法正确的是
(b)的分子式均为C8H8,下列说法正确的是A. a的同分异构体只有b一种
B. a、b的一氯代物分别有5种和3种(不考虑立体异构)
C. a、b均可使溴的四氯化碳溶液退色
D. a、b中所有原子均可能处于同一平面
难度: 困难查看答案及解析
-
下图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨气和氯化氢,烧杯内盛装滴有石蕊试液的蒸馏水。下列说法错误的是

A. 在实验室中,可用浓氨水和生石灰制备氨气,用浓盐酸和浓硫酸制备氯化氢
B. 在实验室中制备干燥的氨气和氯化氢时,可选用相同的干燥剂
C. 实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉
D. 喷泉结束后,将烧瓶内溶液混合后呈紫色,蒸干可得氯化铵固体
难度: 中等查看答案及解析
-
全钒液流储能电池一次性充电后,续航能力可达1000 km,而充电时间只需3~5 min,被誉为“完美电池”,其原理如图所示(已知V2+呈紫色,V3+呈绿色)。电池放电时,左槽溶液质量增加。下列说法正确的是
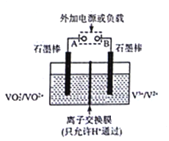
A. 充电时的阴极反应为VO2++2H++e-=VO2++H2O
B. 放电时的正极反应为V3++e-=V2+
C. 放电过程中,右槽溶液由紫色变为绿色
D. 若负载为用石墨电极电解食盐水的装置,生成4gNaOH时该电池中消耗0.1mol H+
难度: 困难查看答案及解析
-
常温下,向0.1mol·L-1H3PO4溶液中加入NaOH的过程中各种微粒的物质的量分数随pH 的变化关系如图所示(H3PO4)的三级电离常数依次为Ka1、Ka2、Ka3、pK=-lgK )。下列叙述错误的是
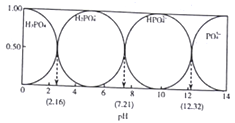
A. pKa1=2.16
B. 溶液呈中性时,[H2PO4-]>[HPO42-]
C. 反应PO43-+H2O
HPO42-+OH-的pK=1.68
D. Na2HPO4溶液中存在[OH-]+[PO43-]=[H+]+[H2PO4-]+[H3PO4]
难度: 困难查看答案及解析