-
碱性电池有容量大,放电电流大的特点,被广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn + 2MnO2 + H2O=Zn(OH)2+Mn2O3。下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2 + H2O+2e-==Mn2O3 + 2OH-
C.外电路中每通过0.2mol电子,锌的质量理论上减少13g
D.电池工作时,电子由负极通过外电路流向正极
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100mL 1mol∙L-1的Na2CO3溶液中CO32-、HCO3-和H2CO3总数为0.1NA
B. 1L 1mol/L醋酸溶液中含有的离子总数为2NA
C. 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
D. 0.1L 3mol·L-1的FeCl3溶液中含有的Fe3+数目为0.3 NA
-
现代火法炼锌过程中发生了以下三个主要反应。下列说法正确的是
① 2ZnS(s) + 3O2(g)=2ZnO(s)+2SO2(g) △H1=a kJ • mol-1
② 2C(s) +O2(g)=2CO(g) △H2=b kJ • mol-1
③ ZnO(s) +CO(g)=Zn(g) +CO2(g) △H3=c kJ • mol-1
A. 以上三个反应中,只有①是放热反应
B. 反应②的作用是仅为反应③提供还原剂
C. 用这种方法得到的是纯净的锌单质
D. 反应ZnS(s)+C(s)+2O2(g)=Zn(g)+SO2(g)+CO2(g)的△H= kJ • mol-1
kJ • mol-1
-
天宫一号搭载的长征二号火箭使用的主要燃料是偏二甲肼(用R表示,其中碳元素显﹣2价、氮元素显﹣2价),N2O4作氧化剂,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R + 2N2O4 = 3N2↑+ 4H2O↑+ 2CO2↑,下列叙述错误的是
A. 燃烧反应放出的巨大能量,把火箭送入太空
B. 每生成1mol N2,该反应转移电子8mol
C. N2既是氧化产物也是还原产物,CO2是氧化产物
D. 此反应中R的分子式为C2H8N2
-
下列事实不能用勒夏特利原理来解释的是
A. 用排饱和食盐水的方法收集氯气
B. 增大压强,有利于SO2和O2反应生成SO3
C. 在Fe3++3SCN- Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
D. 合成氨工业选择高温(合成氨反应为放热反应)
-
下列事实与对应的方程式不符合的是
A. 自然界中正常的雨水呈酸性:H2O+CO2 H2CO3 ,H2CO3
H2CO3 ,H2CO3 H++HCO3—
H++HCO3—
B. “NO2球”浸泡在冷水中,颜色变浅:2NO2(g) (红棕色) N2O4 (g) (无色) ΔH<0
N2O4 (g) (无色) ΔH<0
C. 甲烷的燃烧热为-890.3 kJ·mol—1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
D. 硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32-+2H+=S +SO2 +H2O
-
下列事实说明HNO2为弱电解质的是
①0.1 mol/L HNO2溶液的pH=2.1;
②常温下NaNO2溶液的pH>7 ;
③用HNO2溶液做导电实验时,灯泡很暗;
④HNO2溶液和KCl溶液不发生反应
⑤HNO2能与碳酸钠反应制CO2;
⑥HNO2不稳定,易分解
A. ①②③⑤ B. ①② C. ①②⑥ D. ①②④⑤
-
下列各组溶液中每种溶质的物质的量浓度均为0.1 mol/L:①H2S ②NaHS ③Na2S ④H2S和NaHS混合液。下列说法不正确的是
A. c(S2―)由大到小是:③>①>②>④
B. 溶液pH由大到小的是:③>②>④>①
C. 在H2S 和NaHS混合液中:2c(Na+)=c(H2S)+c(HS―)+c(S2―)
D. 在NaHS溶液中:c(H+)+c(Na+)=c(OH―)+c(HS―)+2c(S2―)
-
下述实验不能达到预期实验目的是
| 序号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸测定NaClO溶液和CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一会过滤 | 除去MgCl2中少量FeCl3 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D
-
下列实验操作、现象与实验结论一致的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | SO2通入Ba(NO3)2溶液中,有白色沉淀生成 | 发生复分解反应生成难溶物质BaSO3 |
| B | 某溶液滴加盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中可能不含SO42- |
| C | 将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别滴加CCl4,振荡,静置,下层分别呈无色和紫红色 | 氧化性:Fe3+﹥Br2﹥I2 |
| D | 向浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1AgNO3溶液,沉淀呈黄色 | Ksp(AgCl)﹤Ksp(AgI) |
A. A B. B C. C D. D
-
一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:2A (g) +B (s) 2D (g) △H<0,测得相关数据如下,分析可知下列说法不正确的是
2D (g) △H<0,测得相关数据如下,分析可知下列说法不正确的是
| | 实验I | 实验II | 实验III |
| 反应温度 / ℃ | 800 | 800 | 850 |
| c( A )起始/mol·L-1 | 1 | 2 | 1 |
| c( A)平衡 /mol·L-1 | 0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
A.实验III的化学平衡常数K<1
B.实验放出的热量关系为b>2a
C.实验III在30min达到平衡时的速率v (A)为0.005mol·L-1·min-1
D.当容器内气体密度不随时间而变化时上述反应已达平衡
-
某体积可变的密闭容器中盛有适量的N2和H2的混合气体,在一定条件下发生反应:N2(g)+3 H2 (g) 2NH3(g),若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中NH3的体积是0.1 V L。下列说法正确的是
2NH3(g),若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中NH3的体积是0.1 V L。下列说法正确的是
A. 原混合气体的体积为1.2V L B. 反应达平衡时N2消耗掉0.2 V L
C. 原混合气体的体积为1.1VL D. 反应达平衡时H2消耗掉0.5 V L
-
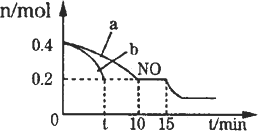
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g) Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是
Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是
A. 该反应的化学方程式是2HF (HF)2
(HF)2
B. 平衡时混合气体的平均摩尔质量是33.3
C. t1时刻,保持温度不变,再充入1molM,重新达到平衡时, 将增大
将增大
D. M的沸点比同主族下一周期元素的气态氢化物沸点低
-
全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,下列说法正确的是
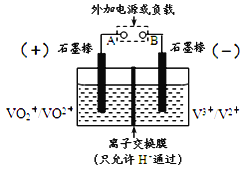
A. 放电时,右槽发生还原反应
B. 放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
C. 充电时,每转移1mol电子,n(H+)的变化量为1mol
D. 充电时,阴极电解液pH升高
-
25 ℃时,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是
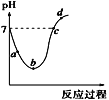
A. 实验进程中水的电离程度:c>a>b
B. 向a点所示溶液中通入SO2,溶液的pH减小,漂白性增强
C. d点所示的溶液中c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
D. c点所示溶液中:c(Na+)=c(ClO-)+c(HClO)
-
常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是
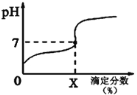
A. HA溶液加水稀释后,溶液中c(HA)/c(A-)的值减小
B. HA的电离常数KHA=10-7x/(100-x)(x为滴定分数)
C. 当滴定分数为100时,溶液中水的电离程度最大
D. 滴定分数大于100时,溶液中离子浓度关系是c(Na+)>c(A-)>c(OH-)>c(H+)
-
室温下,浓度均为0.1mol/L.体积均为V0的NaX、NaY溶液分别加水稀释至体积V。已知pOH=-lgc(OH-),pOH 与 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
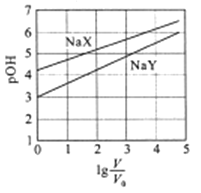
A. HX、HY都是弱酸,且Ka(HX)>Ka(HY)
B. 图中pOH随 变化始终满足直线关系
变化始终满足直线关系
C.  =3时,NaX溶液中所含离子总数小于NaY溶液
=3时,NaX溶液中所含离子总数小于NaY溶液
D. 分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-)
-
下列说法正确的是
A. 25℃时,已知Ka(CH3COOH)=1.7×10-5 mo1·L–1、Ka(C6H5OH)=1.0×10-10 mo1·L–1、Ka1(H2CO3)=4.2×10-7 mo1·L–1、Ka2(H2CO3)=5.6×10-11 mo1·L–1。pH相等的①CH3COONa、②C6H5ONa、③NaHCO3溶液中,c(Na+)大小关系:②<③<①
B. 常温下,某溶液中由水电离出的c(H+)=1×10-a mo1·L–1,若a<7时,则该溶液可能为NaHSO4溶液
C. 常温下,中和同体积、同pH的硫酸、盐酸和醋酸所需相同浓度的NaOH溶液的体积关系:V(硫酸)>V(盐酸)=V(醋酸)
D. 常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸有气泡产生,说明常温下Ksp(BaSO4)>Ksp(BaCO3)
2NO(g) △H=+180.50 kJ·mol-1
2 CO2(g) △H=-566.00kJ·mol-1