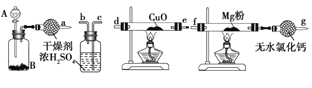
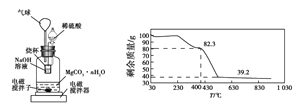
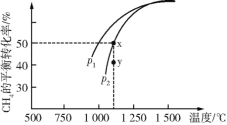
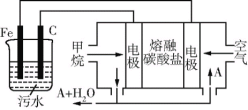
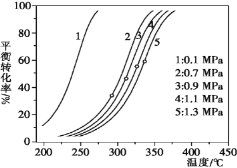
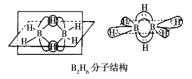
-
化学与生产、生活、社会密切相关,下列说法正确的是
A. 常用危险化学品标签中的阿拉伯数字主要表示的是危险级别
B. 石油裂化和裂解制取乙烯、丙烯等化工原料不涉及化学变化
C. 误食重金属盐引起的人体中毒,可以喝大量的食盐水解毒
D. 少量的生石灰能作为鸡舍和猪栏的消毒剂
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 31 g白磷(
)含有共价键的总数为1.5NA
B. 常温下,22.4 mL H2O中所含氢氧键的数目约为2.49NA
C. 8.7 g MnO2与40 mL 10 mol·L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA
D. 常温下,1 L pH=11的Na2CO3溶液中由水电离出的H+数目为0.001NA
难度: 简单查看答案及解析
-
部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.92 g,经如下处理:

下列说法正确的是①滤液A中的阳离子为Fe2+、Fe3+、H+ ;②样品中氧元素的物质的量为0.03 mol;③溶解样品的过程中消耗硫酸的总物质的量为0.04 mol;④V=224;⑤V=336。
A. ①③④ B. ②③④ C. ②③⑤ D. ①③⑤
难度: 困难查看答案及解析
-
下列化学用语的表述正确的是
A. 葡萄糖的实验式:CH2O B. NaClO的电子式:
C. 甲烷分子的球棍模型:
D. 次氯酸的结构式:H—Cl—O
难度: 简单查看答案及解析
-
有X、Y、Z、M、N五种物质,进行的有关实验操作及现象如下:
实验操作
实验现象
①气体X和气体Y混合
气体变红棕色
②Y、M、N分别与氢硫酸反应
都产生淡黄色固体
③用玻璃棒蘸取Z和M的浓溶液,相互靠近
产生白烟
④Z和N分别通入少量溴水中
溴水都变成无色透明的液体
X、Y、Z、M、N依次可能是
A. NO、O2、NH3、HNO3、SO2 B. O2、NO、NH3、HCl、SO2
C. O2、NO、HCl、NH3、CO2 D. NO、O2、NH3、HCl、CH4
难度: 简单查看答案及解析
-
如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是
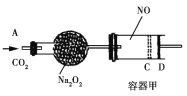
A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况)
B. NO2转化为N2O4的转化率为20%
C. 容器甲中NO已反应完
D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01
难度: 困难查看答案及解析
-
某酯的分子式可表示为CnH2nO2(n为整数),相对分子质量不大于160,且在酸性条件下能水解生成两种相对分子质量相等的有机物,则该酯的结构可能有
A. 15种 B. 23种 C. 28种 D. 32种
难度: 中等查看答案及解析
-
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。现进行如下图所示实验。下列有关说法正确的是

A. 步骤Ⅰ中减少的3 g固体一定是混合物
B. 步骤Ⅱ中质量减少的固体物质一定是Fe2O3
C. 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol
D. 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50%
难度: 困难查看答案及解析
-
已知有机化合物
(b)、
(d)、
(p)。下列说法正确的是
A. b与d互为同系物
B. d中存在少量的b时可以加入NaOH溶液后分液除去
C. b、d、p均可与金属钠反应
D. b、d、p各自同类别的同分异构体数目,d最多
难度: 简单查看答案及解析
-
由下列实验及现象不能推出相应结论的是
选项
实验
现象
结论
A
向添有KIO3的食盐中加入淀粉溶液、稀盐酸及KI
溶液变蓝色
氧化性:IO
>I2
B
向稀氨水和酚酞混合溶液中加入少量Ag2O,振荡
溶液由浅红色变为红色
Ag2O是强碱
C
向装有经过硫酸处理的CrO3(桔红色)的硅胶导管中吹入乙醇蒸气
固体逐渐由桔红色变为浅绿色(Cr3+)
乙醇具有还原性
D
向盛有少量水的烧杯中加入少量Mg2Si
产生白色沉淀,液面上有火苗
Mg2Si水解生成Mg(OH)2和SiH4
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
维生素P的结构如图所示,其中R为烷烃基,维生素P是一种营养增补剂。下列关于维生素P的叙述正确的是( )

A. 分子中的官能团有羟基、碳碳双键、醚键、酯基
B. 若R为甲基,则该物质的分子式可以表示为C16H14O7
C. 该化合物遇三氯化铁溶液发生显色反应
D. 1 mol该化合物与氢气加成所需氢气的物质的量最多是7 mol
难度: 简单查看答案及解析
-
现有FeSO4、Fe2(SO4)3、H2SO4的混合溶液,其中c(H+)=0.10mol/L.取该溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀27.96g;再另取该混合溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.00g.则原混合溶液中c(Fe2+)与c(Fe3+)之比为( )
A.4:1 B.3:1 C.2:1 D.1:1
难度: 中等查看答案及解析
-
常温下,向1 L浓度为0.4 mol·L-1的乙醇酸[CH2(OH)COOH]溶液中加入8 g NaOH固体得到X溶液,将X溶液平均分成两等份,一份通入HCl气体,得到溶液Y,另一份加入NaOH固体得到溶液Z,溶液Y、Z的pH随所加物质的物质的量的变化情况如图所示(体积变化忽略不计)。下列说法正确的是

A. c点对应曲线代表的是加入NaOH的曲线
B. 溶液中水的电离程度:c>b
C. a点:c[CH2(OH)COO-]>c(Na+)>c(H+)>c(OH-)
D. 稀释Y溶液后,溶液中
 变大
变大难度: 中等查看答案及解析
-
根据各物质间的能量循环图,下列说法正确的是

A. ΔH4>0 B. ΔH1+ΔH5=0
C. ΔH2+ΔH3+ΔH4=ΔH6 D. ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,P、M、N均是由这些元素组成的二元化合物,它们存在转化关系Q
P+M+N,P能使湿润的红色石蕊试纸变蓝,M的组成元素位于同一主族,N常温常压下为液体。下列说法不正确的是
A. 原子半径:Y>Z>W>X
B. 简单气态氢化物的热稳定性:Z>Y
C. Q既能与强酸溶液反应,又能与强碱溶液反应
D. Y的最高价氧化物对应的水化物与Q溶液混合,无M生成
难度: 简单查看答案及解析
-
城市地下潮湿的土壤中常埋有纵横交错的管道和输电线路,当有电流泄漏并与金属管道形成回路时,就会引起金属管道的腐蚀。原理如图所示,但若电压等条件适宜,钢铁管道也可能减缓腐蚀,此现象被称为“阳极保护”。下列有关说法不正确的是
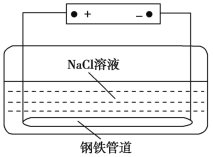
A. 该装置能够将电能转化为化学能
B. 管道右端腐蚀比左端快,右端电极反应式为Fe-2e-
Fe2+
C. 如果没有外加电源,潮湿的土壤中的钢铁管道比较容易发生吸氧腐蚀
D. 钢铁“阳极保护”的实质是在阳极金属表面形成一层耐腐蚀的钝化膜
难度: 中等查看答案及解析
-
用二氧化碳可合成低密度聚乙烯(LDPE)。常温常压下以纳米二氧化钛膜为工作电极,电解CO2,可制得LDPE,该电极反应可能的机理如下图所示。下列说法正确的是

A. 含
的-极与电源负极相连
B. 过程Ⅰ、Ⅱ中碳元素均被还原,过程Ⅲ中碳元素被氧化
C. 电解过程中CO
向阴极迁移
D. 工业上生产1.4×104 g的LDPE,转移电子的物质的量为6×103 mol
难度: 简单查看答案及解析
-
新装修的房屋会释放出有毒的甲醛气体。银-Ferrozine法检测甲醛(HCHO)的原理如下(在原电池中完成氧化银与甲醛的反应)。下列说法正确的是
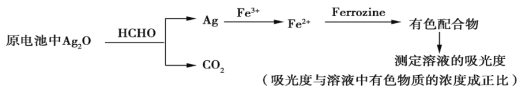
A. 其他条件相同,甲醛浓度越小,所得有色配合物溶液的吸光度越大
B. 电池正极的电极反应式为Ag2O+2H++2e-
2Ag+H2O
C. 30 g HCHO被氧化时,理论上电路中通过2 mol电子
D. 理论上,消耗HCHO和消耗Fe3+的物质的量之比为4∶1
难度: 中等查看答案及解析
-
如图是某化工厂对海水资源综合利用的示意图。根据以上信息,判断下列相关分析不正确的是

A. 上述提取Mg的流程中,没有涉及的反应类型是置换反应
B. 因氮气的化学性质相对稳定,冷却电解无水氯化镁所得的镁蒸气时,可选择氮气
C. 反应⑥所用的气态氧化剂可从本厂生产烧碱处循环利用或从本厂生产镁单质处循环利用
D. 从母液中提取Mg和Br2的先后顺序:先提取Br2,后提取Mg
难度: 困难查看答案及解析
-
关于下列各图的叙述,正确的是

A. 图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B. 图乙表示反应2SO2(g)+O2(g)
2SO3(g)在其他条件不变时,O2的转化率随
的变化关系
C. 图丙表示用0.100 0 mol·L-1的盐酸滴定20.00 mL 0.100 0 mol·L-1Na2CO3溶液的曲线,从A点到B点反应的离子方程式为:CO32-+2H+
CO2↑+H2O
D. 图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度溶液的pH:NaA<NaB
难度: 中等查看答案及解析
-
常温下,用0.100 0 mol·L-1的盐酸滴定20.00 mL未知浓度的氨水,滴定曲线如图所示,滴加20.00 mL盐酸时所得溶液中c(Cl-)=c(NH4+)+c(NH3·H2O)+c(NH3)。下列说法错误的是
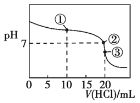
A. 该氨水的浓度为0.100 0 mol·L-1
B. 点①溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=2c(Cl-)
C. 点②溶液中c(NH4+)=c(Cl-)
D. 点③溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-)
难度: 中等查看答案及解析
-
25℃时,用NaOH溶液滴定H2C2O4溶液,溶液中
和
[或
和
]的关系如图所示。下列说法不正确的是

A. 曲线M表示
和
的关系
B. Ka1(H2C2O4)的数量级为10-2
C. 向NaHC2O4溶液中加少量NaOH至c(HC2O4-)和c(C2O42-)相等,此时溶液pH约为5
D. 在NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
难度: 困难查看答案及解析