-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A. 0.1 mol·L−1KI 溶液:Na+、K+、ClO− 、OH−
B. 0.1 mol·L−1Fe2(SO4)3溶液:Cu2+、NH4+ 、NO3−、SO42−
C. 0.1 mol·L−1HCl 溶液:Ba2+、K+、CH3COO−、NO3−
D. 0.1 mol·L−1NaOH溶液:Mg2+、Na+、SO42−、HCO3−
难度: 中等查看答案及解析
-
W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是
A. X与其他三种元素均可形成两种或两种以上的二元化合物
B. Y与其他三种元素分别形成的化合物中只含有离子键
C. 四种元素的简单离子具有相同的电子层结构
D. W的氧化物对应的水化物均为强酸
难度: 中等查看答案及解析
-
下列化学用语对事实的表述不正确的是( )
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O
NH4++OH−
C. 由Na和C1形成离子键的过程:

D. 电解精炼铜的阴极反应:Cu2+ +2e−=Cu
难度: 中等查看答案及解析
-
一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图
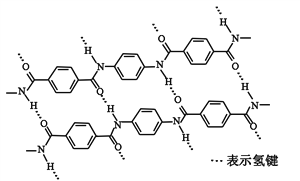
下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:
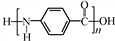
难度: 中等查看答案及解析
-
一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( )
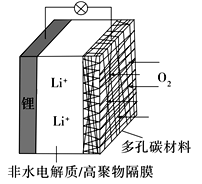
A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1—
)O2
难度: 中等查看答案及解析
-
常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10–6
B. 曲线N表示pH与
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
难度: 困难查看答案及解析